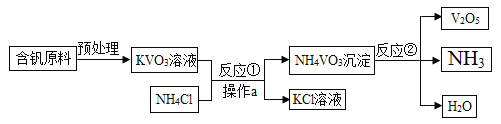
题目内容
【题目】人类生活生产离不开金属,请回答下列问题:
(1)下列现象和事实,不.可.以.用金属活动性作合理解释的是__________。
A.金属镁在空气中比铝更容易燃烧, 说明镁比铝的活动性强
B.金属铝比金属锌更耐腐蚀, 说明锌比铝活动性强
C.用硫酸铜、生石灰加水配制农药波尔多液时,不能用铁制容器
D.金属的种类很多,但在自然界中,仅有少数金属如金、银等有单质形式存在
(2)某小组用如下图所示装置对铁生锈的条件进行探究,四分钟后发现 A 中铁钉表面灰暗,B 中铁钉依然光亮,对比 A、B 现象说明:决定铁生锈快慢的一个重要因素是____。
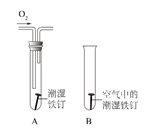
(3)多数金属以矿物形式存在于自然界,金属矿物可以用来冶炼金属。
①高炉炼铁的原料主要是铁矿石、______、石灰石、空气。工业上常用赤铁矿(主要成分是Fe2O3)在高炉中炼铁,反应的化学方程式是___________ 。
②我国古代将炉甘石(ZnCO3)、赤铜(Cu2O)和木炭粉混合后加热到 800℃, 得到貌似金 子的铜锌合金,反应原理如下,试补充完成其中的另外两个化学方程式。
A.ZnCO3=ZnO+CO2↑
B.C+2Cu2O=_____________+CO2↑
C.____________________
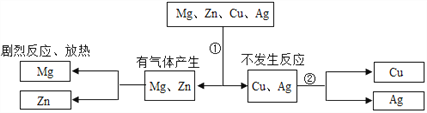
(4)将mgZn和Fe的混合物中加入一定质量的CuCl2,充分反应后过滤,将滤渣洗涤, 干燥后称量质量仍为 mg,对所得滤液和滤渣的判断不正确的是_____________。
A.滤液中一定有ZnCl2和FeCl2 B.滤液为无色
C.滤渣中只有铜 D.滤渣中加稀盐酸一定有气泡产生
【答案】 B 氧气浓度大小 焦炭 Fe2O3+3CO![]() 2Fe+3CO2 4Cu 2ZnO+C
2Fe+3CO2 4Cu 2ZnO+C![]() 2Zn+CO2↑ BCD
2Zn+CO2↑ BCD
【解析】(1)A、金属活动性顺序中镁比铝活泼,更易与氧气反应,正确;
B、金属铝比金属锌更耐腐蚀是由于铝易与空气中的氧气反应生成致密的三氧化二铝保护膜,铝比锌活泼,错误;
C、铁比铜活泼,可以置换出硫酸铜中的铜,故不能用铁器装硫酸铜,正确;
D、自然界中大部分金属较活泼,易与氧气反应,故以化合态的形式存在,少部分金属不活泼,以单质态存在,比如金、银等,正确;故选B;
(2)A装置中比B装置中多了氧气,故决定铁生锈快慢的一个重要因素是氧气的浓度;
(3)① 高炉炼铁的原料主要是铁矿石、焦炭、石灰石、空气;三氧化二铁与一氧化碳在高温的条件下反应生成铁和二氧化碳,反应方程式为: Fe2O3+3CO![]() 2Fe+3CO2;
2Fe+3CO2;
②碳与氧化亚铜反应生成铜和二氧化碳,反应方程式为:C+2Cu2O![]() 4Cu+CO2↑,故填4Cu;木炭与氧化锌在高温的条件下反应生成锌和二氧化碳,反应方程式为:2ZnO+C
4Cu+CO2↑,故填4Cu;木炭与氧化锌在高温的条件下反应生成锌和二氧化碳,反应方程式为:2ZnO+C![]() 2Zn+CO2↑;
2Zn+CO2↑;
(4)A、在金属活动性顺序中锌比铁活泼,故锌先和硫酸铜反应置换出铜,铜的相对原子质量比锌小,故如果只有锌发生反应的话,生成是固体质量要小于mg,故铁也一定参加了反应,故滤液中一定有 ZnCl2 和 FeCl2,正确;
B、锌和铁不一定将硫酸铜完全反应,并且铁与硫酸铜反应后生成的硫酸亚铁是浅绿色,故溶液不是无色,错误;
C、铁将硫酸铜反应完还有可能剩余,故滤渣中可能有铁,错误;
D、当硫酸铜没有反应完时,滤渣中只有铜,故加入稀盐酸就没有气泡,错误;故选BCD;

 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案【题目】某化学兴趣小组的同学在探究氢氧化钠的性质时,将二氧化碳通入盛有氢氧化钠溶液的试管中,没有观察到现象,小组同学对氢氧化钠和二氧化碳是否发生反应产生了兴趣,他们又做了如图所示两组实验.
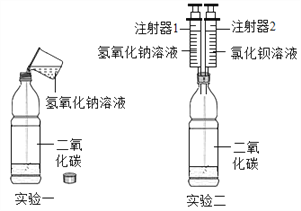
(1)实验一:将氢氧化钠溶液加入装有二氧化碳的软塑料瓶中,旋紧瓶盖振荡,观察到软塑料瓶变瘪,小组同学认为氢氧化钠和二氧化碳发生了反应,反应化学方程式为________.其中一位同学提出了质疑,认为根据上述实验现象不足以证明二者发生了化学反应,其理由是___________,得到了小组其他同学的认同.
(2)实验二:小组同学将实验一做了改进,将注射器1中的氢氧化钠溶液注入拧紧瓶盖的软塑料瓶中振荡,观察到软塑料瓶变瘪,再将注射器2中的氯化钡溶液注入瓶中,观察到_____________,证明氢氧化钠与二氧化碳发生了反应.
(3)实验结束后,兴趣小组的同学又提出了新问题:实验二软塑料瓶内溶液中溶质是什么?
【查阅资料】a.氯化钡溶液呈中性;b.碳酸钡不溶于水.
【设计实验】小组同学继续进行实验,请你补充完整.
实验步骤 | 实验现象 | 实验结论及化学方程式 |
①将软塑料瓶中的物质过滤,取少量滤液于试管中,向其中滴加酚酞溶液 | 溶液不变色 | 软塑料瓶内溶液中的溶质是_______ 步骤②反应的化学方程式______ |
②向步骤①的试管中滴加稀硫酸 | 产生白色沉淀 |
【实验反思】在分析化学反应后所得物质成分时,除考虑生成物外,还需考虑的是________.