题目内容
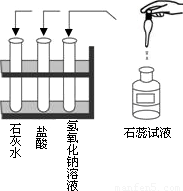
(2010?常熟市模拟)复习时,课堂上老师引导我们回顾了二个探究实验.探究1:在实验室做酸和碱与指示剂反应的实验,所用试剂如图所示,实验后把废液集中倒入废液缸中.
(1)废液呈红色,说明废液显性;
(2)写出废液中所含溶质的化学式.
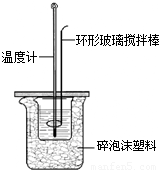
探究2:某学习小组的三位同学为了测定H2SO4与NaOH发生中和反应时放出的热量,他们在下图所示的小烧杯中装入一定量的NaOH溶液,测其温度;另取一定量的硫酸溶液,测其温度后,再缓缓地倾入小烧杯中,并边加边用环形玻璃棒上下移动搅拌,记录溶液温度的变化.甲、乙、丙三位同学实验时选择的试剂情况见表:
| 使用的NaOH情况 | 使用的H2SO 4情况 | |
| 甲 | NaOH固体 | 稀H 2SO 4 |
| 乙 | NaOH稀溶液 | 浓H2SO4 |
| 丙 | NaOH稀溶液 | 稀H2SO4 |
①玻璃棒下端为什么要做成环形?;
②碎泡沫塑料的作用是什么?.
(2)甲、乙、丙三位同学中,有两位同学选择的试剂有错误.从溶液温度改变的因素
考虑,指出错误的原因是:
①同学错误的原因是;
②同学错误的原因是.
(3)另一位回学选择的试剂正确,但用上述实验方法测得的中和热数值都会偏小,试分析可能造成误差的原因:.
【答案】分析:石灰水与盐酸反应生成氯化钙和水,氢氧化钠与盐酸反应生成氯化钠和水,石蕊遇酸变红,遇碱变蓝;氢氧化钠与稀硫酸的中和反应要放出热量,要设计实验证明,需排除干扰因素,氢氧化钠固体和浓硫酸溶于水都会放出热量,另外要注意减小实验误差,即实验过程中减少热量的放出.
解答:解:探究1:(1)石蕊遇酸变红,废液呈红色,说明废液呈酸性,所以本题答案为:酸性;
(2)石灰水与盐酸反应生成氯化钙和水,氢氧化钠与盐酸反应生成氯化钠和水,废液呈酸性,说明一定含盐酸,所以本题答案为:NaCl、CaCl2、HCl;
探究2:(1)①要使氢氧化钠与稀硫酸充分反应,需要不断搅拌,因为用到温度计测定,为防止碰坏温度计,所以可上下搅动,普通玻璃棒的搅拌效果不明显,做成环形易于搅拌,所以本题答案为:便于玻璃棒上下移动就能搅拌溶液,防止破坏温度计;
②为保证实验结果的客观准确性,需防止热量散失,而泡沫塑料具有隔热的作用,所以本题答案为:隔热,防止热量散失;
(2)①氢氧化钠固体溶于水会放热,无法确定热量的变化是反应放出的还是氢氧化钠固体溶于水放出的,对实验结果有干扰,所以本题答案为:NaOH固体溶于水会放热,影响反应热的测定;
②浓硫酸溶于水会放出热量,无法确定热量的变化是反应放出的还是浓硫酸溶于水放出的,对实验结果有干扰,所以本题答案为:浓H2SO4溶于水会放热,影响反应热的测定;
③用上述实验方法测得的中和热数值都会偏小,说明反应过程中有热量的散失,造成热量散失的原因可能与仪器装置有关,也可能与反应物的量有关,所以本题答案为:小烧杯未加盖,热量散失或反应物量太少(其他合理答案均可).
点评:本题考查了实验方案的设计对实验结果的影响,在进行实验设计时,要注意某些变量的控制,同时需考虑药品的选择、仪器装置的选择对实验结果的影响.
解答:解:探究1:(1)石蕊遇酸变红,废液呈红色,说明废液呈酸性,所以本题答案为:酸性;
(2)石灰水与盐酸反应生成氯化钙和水,氢氧化钠与盐酸反应生成氯化钠和水,废液呈酸性,说明一定含盐酸,所以本题答案为:NaCl、CaCl2、HCl;
探究2:(1)①要使氢氧化钠与稀硫酸充分反应,需要不断搅拌,因为用到温度计测定,为防止碰坏温度计,所以可上下搅动,普通玻璃棒的搅拌效果不明显,做成环形易于搅拌,所以本题答案为:便于玻璃棒上下移动就能搅拌溶液,防止破坏温度计;
②为保证实验结果的客观准确性,需防止热量散失,而泡沫塑料具有隔热的作用,所以本题答案为:隔热,防止热量散失;
(2)①氢氧化钠固体溶于水会放热,无法确定热量的变化是反应放出的还是氢氧化钠固体溶于水放出的,对实验结果有干扰,所以本题答案为:NaOH固体溶于水会放热,影响反应热的测定;
②浓硫酸溶于水会放出热量,无法确定热量的变化是反应放出的还是浓硫酸溶于水放出的,对实验结果有干扰,所以本题答案为:浓H2SO4溶于水会放热,影响反应热的测定;
③用上述实验方法测得的中和热数值都会偏小,说明反应过程中有热量的散失,造成热量散失的原因可能与仪器装置有关,也可能与反应物的量有关,所以本题答案为:小烧杯未加盖,热量散失或反应物量太少(其他合理答案均可).
点评:本题考查了实验方案的设计对实验结果的影响,在进行实验设计时,要注意某些变量的控制,同时需考虑药品的选择、仪器装置的选择对实验结果的影响.

练习册系列答案
相关题目