题目内容
【题目】溶解度可表示物质溶解性的大小.
(1)如图是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线. 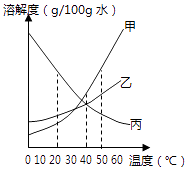
①20℃时,甲的溶解度(填“>”、“<”或“=”)乙的溶解度.
②40℃时,乙和丙(填“能”或“不能”)形成溶质质量分数相同的饱和溶液.
③20℃时,烧杯中分别盛有相同质量甲、乙、丙的饱和溶液,各加入等质量的对应固体,并升温至50℃.请填写下表.
烧杯中的溶质 | 烧杯中固体的变化 |
甲 | 固体逐渐 |
乙 | 固体逐渐 |
丙 | 固体逐渐 |
(2)气体的溶解度也有一定的变化规律: 打开可乐瓶,逸出大量气泡.由此可见,压强越小,CO2的溶解度越 . 为增大CO2的溶解度,可采用的一种方法是 .
【答案】
(1)<;能;全部溶解;部分溶解;固体不溶解,反而增多
(2)小;增大压强或降低温度
【解析】解:(1)由溶解度曲线可知:20℃时,甲的溶解度小于乙的溶解度;40℃时,乙和丙能形成溶质质量分数相同的饱和溶液,因为它们在该温度下有交点;20℃时,烧杯中分别盛有相同质量甲、乙、丙的饱和溶液,各加入等质量的对应固体,并升温至50℃,甲固体全部溶解,乙固体部分溶解,丙固体不溶解,反而增多;因为甲、乙两种固体物质的溶解度,都是随温度升高而增大,甲变化比乙大,而丙的溶解度随温度的升高而减少;所以答案是:①<;②能;③全部溶解;部分溶解;固体不溶解,反而增多;(2)打开可乐瓶,逸出大量气泡.由此可见,压强越小,CO2的溶解度越小,为增大CO2的溶解度,可采用的一种方法是:增大压强或降低温度;所以答案是:小;增大压强或降低温度;
【考点精析】解答此题的关键在于理解固体溶解度曲线及其作用的相关知识,掌握1.查找指定温度时物质的溶解度,并根据溶解度判断溶解性.2.比较相同温度时(或一定温度范围内)不同物质溶解度的大小.3.比较和确定物质的溶解度受温度影响的程度,并据此确定物质结晶或混合物分离提纯的方法.4.确定溶液的状态(饱和与不饱和),以及对气体溶解度的影响因素的理解,了解气体的溶解度:(1)气体溶解度的定义:在压强为101kPa和一定温度时,气体溶解在1体积水里达到饱和状态时的气体体积.(2)影响因素: ①气体的性质②温度(温度越高,气体溶解度越小)③压强(压强越大,气体溶解度越大).