题目内容
 <1>生活中蕴含科学,留心处皆学问.请用下列序号填空:
<1>生活中蕴含科学,留心处皆学问.请用下列序号填空:①Na2CO3 ②CaO ③NH4H2PO4 ④C6H12O6 ⑤氯化钠 ⑥稀有气体
(1)人体血糖含量的“糖”
④
④
;(2)与水反应放热可以煮鸡蛋
②
②
;(3)可作复合肥料
③
③
;(4)侯氏联合制碱法的主产品
①
①
;(5)可用作保护气的是
⑥
⑥
;(6)常用作调味剂的是
⑤
⑤
.<2>化学世界千变万化,请完成下列问题(③、④两题用化学方程式表示):
(1)新鲜的蔬菜水果中含有的营养素主要是
维生素
维生素
和水;(2)用洗洁精洗去餐具上的油污属于
乳化
乳化
现象;(3)用稀硫酸除去铁锈(以Fe2O3表示):
Fe2O3+3H2SO4═Fe2(SO4)3+3H2O
Fe2O3+3H2SO4═Fe2(SO4)3+3H2O
;(4)汽车受到撞击时,30毫秒内安全气囊中NaN3分解为氮气和钠:
2NaN3
2Na+3N2↑
| ||
2NaN3
2Na+3N2↑
.
| ||
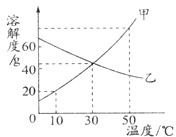
<3>如图是甲、乙两种物质(均不含结晶水)的溶解度曲线.
(1)当温度为
30
30
℃时,甲和乙的溶解度相等;(2)10℃时甲的溶解度为
20g
20g
,该温度下甲的饱和溶液中,溶质和溶液的质量比为1:6
1:6
;(3)分别将50℃时甲、乙的饱和溶液降温至30℃,所得溶液中溶质的质量分数甲
>
>
乙(填:“>”、“=”或“<”).分析:<1>根据物质的性质进行分析,碳酸钠是侯氏制碱法的产品,氧化钙与水反应放出大量的热,复合肥是指含有氮磷钾中至少两种元素的肥料,血糖中的糖是指葡萄糖,稀有气体可用作保护气,食盐是最常用的调味剂;
<2>(1)根据蔬菜水果中营养元素的含量考虑;(2)根据洗洁精洗餐具上的油污的过程考虑;(3)根据用稀硫酸除去铁锈的原理分析;(4)根据汽车受到撞击时,30毫秒内安全气囊中NaN3分解为氮气和钠结合化学方程式的书写方法分析;
<3>(1)由溶解度曲线,找出曲线在指定温度下相交的两种物质;
(2)利用物质的溶解度曲线,查出甲物质在10℃的溶解度的大小;
(3)根据物质的溶解度随温度的变化情况,并据此比较两物质饱和溶液在降温时的质量分数大小的变化.
<2>(1)根据蔬菜水果中营养元素的含量考虑;(2)根据洗洁精洗餐具上的油污的过程考虑;(3)根据用稀硫酸除去铁锈的原理分析;(4)根据汽车受到撞击时,30毫秒内安全气囊中NaN3分解为氮气和钠结合化学方程式的书写方法分析;
<3>(1)由溶解度曲线,找出曲线在指定温度下相交的两种物质;
(2)利用物质的溶解度曲线,查出甲物质在10℃的溶解度的大小;
(3)根据物质的溶解度随温度的变化情况,并据此比较两物质饱和溶液在降温时的质量分数大小的变化.
解答:解:<1>(1)人体血糖含量的“糖”是葡萄糖;
(2)氧化钙与水反应放出大量的热,可以煮鸡蛋;
(3)磷酸二氢铵中含有氮元素和磷元素,属于复合肥料;
(4)碳酸钠是侯氏制碱法的主要产品;
(5)稀有气体化学性质稳定,可用作保护气;
(6)食盐是最常用的调味剂.
故答案为:(1)④;(2)②;(3)③;(4)①;(5)⑥;(6)⑤;
<2>(1)新鲜的蔬菜和水果中90%的是水分,剩余的主要是维生素;
(2)洗洁精洗餐具上的油污是利用洗洁精把大的油滴分散成小的油滴,能够被水冲走,这属于乳化作用;
(3)用稀硫酸除去铁锈的反应物是硫酸和氧化铁,生成物是硫酸铁和水,反应的化学方程式是3H2SO4+Fe2O3=Fe2(SO4)3+3H2O;
(4)该反应的反应物是NaN3,生成物是氮气和钠,反应条件是撞击,反应的化学方程式是2NaN3
2Na+3N2↑.
故答案为:(1)维生素;(2)乳化;(3)3H2SO4+Fe2O3=Fe2(SO4)3+3H2O;(4)2NaN3
2Na+3N2↑;
<3>(1)30℃时,甲和乙的溶解度相等;
(2)10℃时甲的溶解度为20g,该温度下甲的饱和溶液中,溶质和溶液的质量比为20g:120g=1:6;
(3)由于在50℃时,两种物质的溶解度大小关系是甲>乙,即在50℃时,两种物质的饱和溶液中溶质的质量分数:甲>乙;由于甲的溶解度随温度的降低而减小,因此降温至30℃,甲的溶液中会有晶体析出,溶液还是饱和溶液,但质量分数减小;而由于乙的溶解度随温度的降低而增大,因此降温至30℃时,它的饱和溶液就会变成不饱和溶液,但溶液中溶质的质量分数不变,由图可知,30℃时甲的溶解度比50℃时乙溶解度大,因此降温后乙溶液中溶质的质量分数比甲小,即所得溶液中溶质的质量分数甲>乙.
故答案为:(1)30;(2)20g;1:6;(3)>
(2)氧化钙与水反应放出大量的热,可以煮鸡蛋;
(3)磷酸二氢铵中含有氮元素和磷元素,属于复合肥料;
(4)碳酸钠是侯氏制碱法的主要产品;
(5)稀有气体化学性质稳定,可用作保护气;
(6)食盐是最常用的调味剂.
故答案为:(1)④;(2)②;(3)③;(4)①;(5)⑥;(6)⑤;
<2>(1)新鲜的蔬菜和水果中90%的是水分,剩余的主要是维生素;
(2)洗洁精洗餐具上的油污是利用洗洁精把大的油滴分散成小的油滴,能够被水冲走,这属于乳化作用;
(3)用稀硫酸除去铁锈的反应物是硫酸和氧化铁,生成物是硫酸铁和水,反应的化学方程式是3H2SO4+Fe2O3=Fe2(SO4)3+3H2O;
(4)该反应的反应物是NaN3,生成物是氮气和钠,反应条件是撞击,反应的化学方程式是2NaN3
| ||
故答案为:(1)维生素;(2)乳化;(3)3H2SO4+Fe2O3=Fe2(SO4)3+3H2O;(4)2NaN3
| ||
<3>(1)30℃时,甲和乙的溶解度相等;
(2)10℃时甲的溶解度为20g,该温度下甲的饱和溶液中,溶质和溶液的质量比为20g:120g=1:6;
(3)由于在50℃时,两种物质的溶解度大小关系是甲>乙,即在50℃时,两种物质的饱和溶液中溶质的质量分数:甲>乙;由于甲的溶解度随温度的降低而减小,因此降温至30℃,甲的溶液中会有晶体析出,溶液还是饱和溶液,但质量分数减小;而由于乙的溶解度随温度的降低而增大,因此降温至30℃时,它的饱和溶液就会变成不饱和溶液,但溶液中溶质的质量分数不变,由图可知,30℃时甲的溶解度比50℃时乙溶解度大,因此降温后乙溶液中溶质的质量分数比甲小,即所得溶液中溶质的质量分数甲>乙.
故答案为:(1)30;(2)20g;1:6;(3)>
点评:本题考查了的知识点较多,属于化学基础知识和基本概念的考查,认真分析,难度不大.

练习册系列答案
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案
相关题目
 <1>生活中蕴含科学,留心处皆学问.请用下列序号填空:
<1>生活中蕴含科学,留心处皆学问.请用下列序号填空: