题目内容
原煤中含有硫元素,在燃烧过程中产生的二氧化硫会造成大气的污染.某煤场向原煤中加入适量的生石灰制成供居民采暖用的“环保煤”,以减少二氧化硫的排放,消弱二氧化硫对空气的污染.燃烧时生石灰吸收二氧化硫的化学方程式为:2CaO+mSO2+O2
| ||
(1)m值是
(2)若煤厂一次共加入含氧化钙80%的生石灰1400t,则理论上最多可吸收二氧化硫多少吨?
分析:(1)由质量守恒定律可知:反应前后原子的种类和数目不变,可以推出m的值,
(2)根据化学方程式的计算,有一种反应物可以求出另一种物质的质量.
(2)根据化学方程式的计算,有一种反应物可以求出另一种物质的质量.
解答:解:(1)方程式的左边有2个钙原子,所以,n为2,m为2;
(2)设理论上最多吸收二氧化硫的质量为x.
2CaO+2SO2+O2
2CaSO4
112 128
1400t×80% x
x=1280t
故答为(1)2;
(2)1280t.
(2)设理论上最多吸收二氧化硫的质量为x.
2CaO+2SO2+O2
| ||
112 128
1400t×80% x
x=1280t
故答为(1)2;
(2)1280t.
点评:根据有质量守恒定律由反应前后原子的种类和数目不变,可以推断化学式,也可以推断方程式中计量数.

练习册系列答案
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案
相关题目
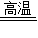 nCaSO4请回答下列问题:
nCaSO4请回答下列问题: nCaSO4请回答下列问题:
nCaSO4请回答下列问题: