题目内容
【题目】向一定质量、一定溶质质量分数的稀盐酸中逐滴加入某碳酸钠溶液.实验过程中,产生气体质量与加入碳酸钠溶液的质量关系如图所示,试计算: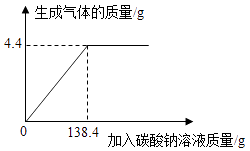
①恰好完全反应时,生成气体的质量为多少克?
②恰好完全反应时,所加碳酸钠溶液中Na2CO3的质量是多少?
③若恰好完全反应时所得溶液的溶质质量分数为5%,则稀盐酸的溶质质量分数是多少?
【答案】解:①恰好完全反应时生成CO2的质量为4.4g;
②设恰好完全反应时,所加碳酸钠溶液中Na2CO3的质量为x,碳酸钠完全反应生成氯化钠的质量为y,消耗稀盐酸的溶质质量为z
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 73 117 44
x z y 4.4g![]()
x=10.6g,![]()
z=7.3g,
y=11.7g,
若恰好完全反应时所得溶液的质量= ![]() =234g,
=234g,
稀盐酸的溶夜质量=234g+4.4g﹣138.4g=100g,
则稀盐酸的溶质质量分数是 ![]() 100%=7.3%.
100%=7.3%.
答案:①4.4;②恰好完全反应时,所加碳酸钠溶液中Na2CO3的质量是10.6g;③稀盐酸的溶质质量分数是7.3%.
【解析】①由图中数据可知恰好完全反应时生成CO2的质量;
②根据二氧化碳的质量,利用反应的化学方程式计算碳酸钠的质量,进一步可以计算两种物质恰好完全反应时所得溶液的溶质质量分数.本题主要考查化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.本题较复杂,计算的知识点多,学生利用图象分析出二氧化碳的质量代入化学反应方程式计算是解答的突破口.
【考点精析】通过灵活运用根据化学反应方程式的计算,掌握各物质间质量比=系数×相对分子质量之比即可以解答此题.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目