题目内容
现称取2克该漂白粉样品,加水溶解配成250毫升溶液.从中取出25毫升该溶液到入一只烧杯中.在该烧杯中加入适量的稀硫酸,测得用掉溶质质量分数为1%的硫酸溶液9.8g.试计算:
(1)2g的漂白粉生成氯气的质量;
(2)该漂白粉的X%.
信息:工业上表示漂白粉的质量优劣公式:X%═
×100%
化学方程式为:Ca(ClO2)2+CaCl2+2H2SO4═2CaSO4+2Cl2+2H2O.
(1)2g的漂白粉生成氯气的质量;
(2)该漂白粉的X%.
信息:工业上表示漂白粉的质量优劣公式:X%═
| 氯气的质量 | 漂白粉的质量 |
化学方程式为:Ca(ClO2)2+CaCl2+2H2SO4═2CaSO4+2Cl2+2H2O.
分析:依据方程式中硫酸的质量可求生成的氯气质量,而后根据共有的250mL溶液是反应的溶液的10倍可求2g的漂白粉生成氯气的质量;进而利用信息可求X%;
解答:解:(1)设1%的硫酸溶液9.8g反应可生成氯气的质量是y;
Ca(ClO2)2+CaCl2+2H2SO4═2CaSO4+2Cl2+2H2O
196 142
9.8g×1% y
=
y=0.071g
所以2g的漂白粉生成氯气的质量是0.071g×10=0.71g
(2)根据工业上表示漂白粉的质量优劣公式:X%═
×100%可知:X%=
×100%=3.55%;
答:(1)2g的漂白粉生成氯气的质量为0.71g(2)该漂白粉的X%为3.55%.
Ca(ClO2)2+CaCl2+2H2SO4═2CaSO4+2Cl2+2H2O
196 142
9.8g×1% y
| 196 |
| 9.8×1% |
| 142 |
| y |
y=0.071g
所以2g的漂白粉生成氯气的质量是0.071g×10=0.71g
(2)根据工业上表示漂白粉的质量优劣公式:X%═
| 氯气的质量 |
| 漂白粉的质量 |
| 0.71g |
| 2g |
答:(1)2g的漂白粉生成氯气的质量为0.71g(2)该漂白粉的X%为3.55%.
点评:此题是有关化学方程式计算的考查题,解题的关键是找到反应的已知的质量和要求的质量;

练习册系列答案
相关题目
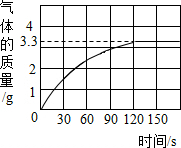 已知某铜矿样品中主要成分是Cu2(OH)2CO3(碱式碳酸铜),Cu2(OH)2CO3(碱式碳酸铜)与稀盐酸反应的化学方程式为:Cu2(OH)2CO3+4HCl═2CuCl2+CO2↑+3H2O.现称取22.2g该铜矿样品放入烧杯中,再加入稀盐酸充分反应,放出气体的总质量与所滴入稀盐酸的质量关系曲线如图所示(假设铜矿中的杂质不与稀盐酸反应).请根据题意回答问题:
已知某铜矿样品中主要成分是Cu2(OH)2CO3(碱式碳酸铜),Cu2(OH)2CO3(碱式碳酸铜)与稀盐酸反应的化学方程式为:Cu2(OH)2CO3+4HCl═2CuCl2+CO2↑+3H2O.现称取22.2g该铜矿样品放入烧杯中,再加入稀盐酸充分反应,放出气体的总质量与所滴入稀盐酸的质量关系曲线如图所示(假设铜矿中的杂质不与稀盐酸反应).请根据题意回答问题:
