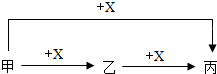题目内容
下列物质由H、C、O、Fe四种元素中的一种或几种组成,它们是初中化学常见的物质.(1)若某单质为最清洁的燃料,它的化学式是 .
(2)若某化合物能燃烧,则化合物中一定含有的元素是 .
(3)甲、乙、丙三种物质在一定条件下存在如下转化关系(图中已略去部分物质).

①若只有甲为固体,其他物质均为气体,则X是 ,乙→丙反应的化学方程式是 .
②若甲、乙、丙均为固体,且甲为红色,乙和丙为黑色,在甲与X 生成乙的反应中甲与X的质量比为120:7.甲→丙反应的化学方程式是 ,甲→乙反应的化学方程式是 .
【答案】分析:(1)根据氢气是最清洁的燃料分析解答;
(2)依据化合物含有多种元素,所以可知该物质中含有的元素情况;
(3)①依据甲为固体,所以可猜想甲是碳,乙是一氧化碳X是氧气,据此分析解答;
②若甲、乙、丙均为固体,且甲为红色,乙和丙为黑色,则可猜想甲是氧化铁,乙是四氧化三铁,据此分析解答即可;
解答:解:(1)最清洁的燃料单质是氢气(H2),因为氢气燃烧后会生成水;
(2)H、C、O、Fe组成的能够燃烧的化合物有有机物和一氧化碳,所以则化合物中一定含有的元素是碳元素(C);
(3)①依据甲为固体,所以可猜想甲是碳,乙是一氧化碳X是氧气,碳的不完全燃烧可以生成一氧化碳,一氧化碳和氧气反应又可以生成二氧化碳,碳充分燃烧也可以生成二氧化碳,所以假设合理,则X是O2;乙→丙反应的化学方程式是2CO+O2 2CO2;
2CO2;
②由甲为红色的固体,由C、H、O、Fe这四种物质组成的化合物中只有Fe2O3为红色,甲和X在反应中的质量比为120:7,推出X为CO(由以上几种元素组成的物质中相对原子量是7的倍数且具有还原性的物质只有CO),根据甲和X质量比为120:7,在甲和X的反应中CO量不足,反应不充分,部分氧化还原,生成 Fe3O4;所以甲→丙反应的化学方程式Fe2O3+3CO 2Fe+3CO2;甲→乙反应的化学方程式是3Fe2O3+CO
2Fe+3CO2;甲→乙反应的化学方程式是3Fe2O3+CO  2Fe3O4+CO2;
2Fe3O4+CO2;
故答案为:(1)H2;(2)C;(3)①O2;2CO+O2 2CO2;②Fe2O3+3CO
2CO2;②Fe2O3+3CO 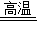 2Fe+3CO2;3Fe2O3+CO
2Fe+3CO2;3Fe2O3+CO  2Fe3O4+CO2;
2Fe3O4+CO2;
点评:此题是对物质性质的考查,解题的关键是掌握常见物质的有关性质并依据物质的性质进行大胆的猜测
(2)依据化合物含有多种元素,所以可知该物质中含有的元素情况;
(3)①依据甲为固体,所以可猜想甲是碳,乙是一氧化碳X是氧气,据此分析解答;
②若甲、乙、丙均为固体,且甲为红色,乙和丙为黑色,则可猜想甲是氧化铁,乙是四氧化三铁,据此分析解答即可;
解答:解:(1)最清洁的燃料单质是氢气(H2),因为氢气燃烧后会生成水;
(2)H、C、O、Fe组成的能够燃烧的化合物有有机物和一氧化碳,所以则化合物中一定含有的元素是碳元素(C);
(3)①依据甲为固体,所以可猜想甲是碳,乙是一氧化碳X是氧气,碳的不完全燃烧可以生成一氧化碳,一氧化碳和氧气反应又可以生成二氧化碳,碳充分燃烧也可以生成二氧化碳,所以假设合理,则X是O2;乙→丙反应的化学方程式是2CO+O2
 2CO2;
2CO2;②由甲为红色的固体,由C、H、O、Fe这四种物质组成的化合物中只有Fe2O3为红色,甲和X在反应中的质量比为120:7,推出X为CO(由以上几种元素组成的物质中相对原子量是7的倍数且具有还原性的物质只有CO),根据甲和X质量比为120:7,在甲和X的反应中CO量不足,反应不充分,部分氧化还原,生成 Fe3O4;所以甲→丙反应的化学方程式Fe2O3+3CO
 2Fe+3CO2;甲→乙反应的化学方程式是3Fe2O3+CO
2Fe+3CO2;甲→乙反应的化学方程式是3Fe2O3+CO  2Fe3O4+CO2;
2Fe3O4+CO2;故答案为:(1)H2;(2)C;(3)①O2;2CO+O2
 2CO2;②Fe2O3+3CO
2CO2;②Fe2O3+3CO 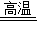 2Fe+3CO2;3Fe2O3+CO
2Fe+3CO2;3Fe2O3+CO  2Fe3O4+CO2;
2Fe3O4+CO2;点评:此题是对物质性质的考查,解题的关键是掌握常见物质的有关性质并依据物质的性质进行大胆的猜测

练习册系列答案
相关题目