题目内容
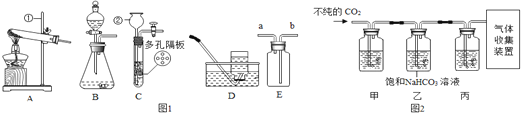
【题目】环保问题越来越成为老百姓关注的焦点,工厂排放的废水要先净化后排放。某工厂排放的废水中含有亚硫酸钠(Na2SO3),未经处理排放到河里会造成污染。某校科学兴趣小组同学对废水处理设计了如图所示的实验方案。(已知氯化钙不与废水中的其它杂质反应)
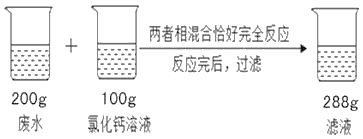
(1)反应生成的亚硫酸钙(CaSO3)沉淀的质量为_____g
(2)计算除去实验方案中的亚硫酸钠,需要质量分数为多少的氯化钙溶液_____?
【答案】12 11.1%
【解析】
根据质量守恒定律可得,生成的亚硫酸钙的质量为200g+100g﹣288g=12g,
设需要的氯化钙溶液质量分数为x
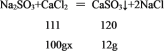
![]()
x=11.1%
答:(1)反应生成的亚硫酸钙(CaSO3)沉淀的质量为 12g。
(2)除去实验方案中的亚硫酸钠,需要质量分数为11.1%的氯化钙溶液。

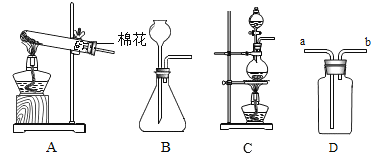
【题目】兴趣小组的同学利用提供的试剂:稀硫酸、澄清石灰水、氯化钠溶液、硫酸铜溶液和紫色石蕊溶液,探究酸碱盐的性质,小清同学将氯化钠溶液加入到稀硫酸中没有观察到明显现象,而将混合溶液加热一段时间后,意外地得到无色、有刺激性气味的气体.
(提出问题)刺激性气味的气体是什么?
(猜想与假设)猜想1.可能是二氧化硫;猜想2.可能是氯化氢;猜想3.可能是氨气
大家讨论后认为猜想3不合理,依据是_____.
(查阅资料)SO2和CO2的化学性质相似都能使澄清石灰水变浑浊,写出二氧化硫和氢氧化钙反应的化学方程式_____;
(实验探究)如图所示,小诚将产生的气体通入紫色石蕊溶液中,观察到_____,他认为猜想2正确.
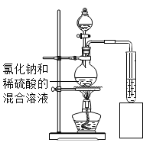
(评价与改进)小煜认为小诚的结论不科学,于是他利用提供的试剂通过实验确认了猜想2正确.
实验操作 | 实验现象 |
如图所示,将产生的气体_____ | 无明显现象 |
为进一步证明结论正确,他们又将该气体通入_____溶液中,观察到了预期的白色沉淀.
(结论)加热氯化钠和硫酸的混合物溶液得到的气体是氯化氢.
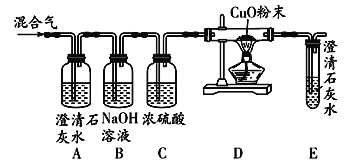
【题目】H2O2生成O2的快慢与催化剂种类是否有关,以下是他们探究的主要过程:
(假设)H2O2生成O2的快慢与催化剂种类有关
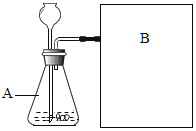
(实验方案)常温下,在两瓶同质量、同浓度的H2O2溶液中,分别加入二氧化锰和水泥块,生成一瓶25mL氧气
(进行实验)如图是他们进行实验的装置图,气体发生装置中A仪器名称是______,此实验中B处宜采用的气体收集方法是______。
(实验记录)
实验 | 过氧化氢溶液 | 气体物质 | 待测数据 |
1 | 5%20g | 无其它物质 | ______ |
2 | 5%20g | 水泥块0.5g | ______ |
3 | 5%20g | 二氧化锰 ______ g | ______ |
待测数据是______;二氧化锰______g。
(结论)该探究过程得出的结论是______。