题目内容
【题目】某化学兴趣小组的同学称取10.0g铜锌合金样品研成粉末装入烧杯中,再向其中逐渐加入100.0g稀盐酸,实验情况如图所示,求: 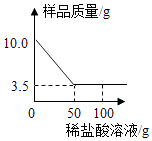
(1)铜锌合金中,Zn的质量是g.
(2)所用稀盐酸中溶质的质量分数是多少?(写出计算过程,计算结果保留到0.1%)
【答案】
(1)6.5
(2)解:所用稀盐酸中溶质的质量是x
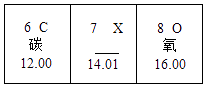
Zn+ | 2HCl═ZnCl2+H2↑ |
65 | 73 |
6.5g | x |
![]()
x=7.3g
故所用稀盐酸中溶质的质量分数是: ![]() ;所用稀盐酸中溶质的质量分数是14.6%.
;所用稀盐酸中溶质的质量分数是14.6%.
【解析】解:(1)金属的锌的质量为:10.0g﹣3.5g=6.5g,故填:6.5;
【考点精析】认真审题,首先需要了解根据化学反应方程式的计算(各物质间质量比=系数×相对分子质量之比).

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案
相关题目