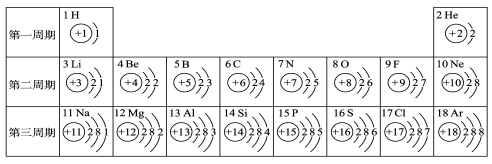
题目内容
【题目】向一定质量CaCl2和HCl的混合溶液中逐滴加入溶质质量分数为10.0%的Na2CO3溶液。反应过程中加入的Na2CO3溶液的质量与产生沉淀或气体的质量关系如图所示。下列说法不正确的是
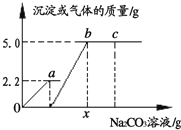
A.c点溶液中溶质有2种
B.图中0a段表示生成沉淀的过程
C.整个反应过程中,氯离子个数不变
D.x值为106.0
【答案】B
【解析】
试题分析:A. b点表示氯化钙和碳酸钠恰好完全反应,生成氯化钠和碳酸钙,而c点表示加入的碳酸钠过量,则溶液中溶质有碳酸钠和氯化钠两种,正确;B. 图中0a段表示碳酸钠与稀盐酸反应生成二氧化碳气体的过程,错误; C.依据质量守恒定律可知,整个反应过程中,氯离子个数不变,正确;D. 根据化学方程式进行计算。与稀盐酸反应消耗碳酸钠溶液的质量为:
Na2CO3+2HCl==2NaCl+H2O+CO2↑
106 44
10%m 2.2g
106/44=10%m/ 2.2g m=53.0g
与氯化钙反应消耗碳酸钠溶液的质量为:
Na2CO3+ CaCl2 ==CaCO3↓+2NaCl
106 100
10.0%n 5g
106/100=10.0%n/5g
n=53.0g
则 x值=m+n=106.0g ,正确。故选B

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目