题目内容
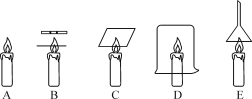
【题目】如图是电解水的简易装置:

(1)C试管中收集到的气体与D试管中收集到的气体的体积比为______。
(2)本实验中,若与电源正极相连的试管中产生10mL 气体,则与负极相连的试管中产生______mL的气体,该实验可得出的结论:水是由_______组成的化合物。
【答案】2︰1 20 氢、氧两种元素
【解析】
(1)电解水时,可观察到:与电源正极相连的试管内产生的气体体积少,与电源负极相连的试管内的气体体积多;两者的体积之比大约是1:2。由图中电解水的简易装置可知,C试管中收集到的气体较多,D试管中收集到的气体较少,两者的体积之比大约是2:1;
(2)给水通电的实验中,若电源正极产生10mL氧气,则负极产生20mL的氢气;电解水时生成氢气和氧气,氢气是由氢元素组成,氧气是由氧元素组成,化学变化中元素的种类不变,该实验可得出的结论:水是由氢元素和氧元素组成的化合物。

【题目】下图所示为实验室中常见的气体制备和收集装置。
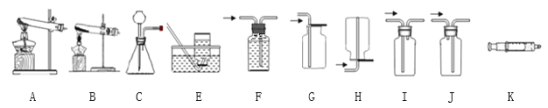
(1)实验室用高锰酸钾制取氧气,应选用发生装置_________(填字母序号,下空相同),收集装置可以选择__________,反应的文字表达为_______。
(2)注射器K可用于检查装置C的气密性,步骤如下:
①向锥形瓶中加入水至___________处。
②将注射器K连接到装置C的导管口处。
③缓慢拉动注射器K的活塞,观察到_______,表示装置C的气密性良好。
(3)为了研究用向上排空气法和排水法收集的氧气浓度是否有差异,做了如下实验:加热高锰酸钾固体,分别用两种方法各收集三瓶氧气,并使用传感器测定收集到的氧气浓度,数据见表。
收集方法 | 向上排空气法 | 排水法 | ||||
氧气浓度% | 79.6 | 79.7 | 79.9 | 90.0 | 89.8 | 89.3 |
氧气平均浓度% | 79.7 | 89.7 | ||||
①用向上排空气法收集氧气时,以__________为氧气集满标准;
用排水法收集氧气时,以观察到_________为氧气集满的标准。
②以上两种方法中,______________法收集到的氧气更纯净。
③向上排空气法收集到的氧气浓度只有80%左右的原因有_________。
A.氧气的密度略大于空气的密度
B.加热高锰酸钾固体产生氧气的浓度只有80%左右
C.当观察到带火星木条复燃时,集气瓶内还有空气
D.当氧气进入集气瓶时,瓶内空气与进入的氧气相互扩散
【题目】某学习小组做镁在空气中燃烧实验时,发现生成物中有黑色固体,针对这一现象及该反应的应用,他们开展了如下探究,请仔细阅读并完成下列探究报告。
(探究目的)探究黑色固体是镁与空气中什么物质反应产生的。
(分析猜想)分析空气中各种成分,寻找猜想依据:
空气成分一:氧气; 空气成分二:氮气; 空气成分三:水蒸气;空气成分四:二氧化碳;空气成分五:稀有气体:化学性质很稳定,一般不与其它物质反应。
(实验一)镁带与氧气的反应
(一)制取氧气并探究氯酸钾和二氧化锰制氧气的实验中反应物与催化剂的最佳质量比。
实验中采用如图1、2所示装置,取20g氯酸钾,分成10等份,每份2g,分别装入10支试管中。在10支试管中分别加入不同质量的二氧化锰,分别测量二氧化锰与氯酸钾在不同质量比时,生成200mL氧气所消耗的时间。实验记录的数据如表:
实验编号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
二氧化锰的质量/g | 0.1 | 0.2 | 0.33 | 0.4 | 0.5 | 0.66 | 1 | 1.3 | 2 | 3 |
二氧化锰与氯酸钾的质量比 | 1:20 | 1:10 | 1:6 | 1:5 | 1:4 | 1:3 | 1:2 | 2:3 | 1:1 | 3:2 |
生成200mL氧气时间/秒 | 235 | 186 | 162 | 147 | 133 | 117 | 143 | 160 | 211 | 244 |
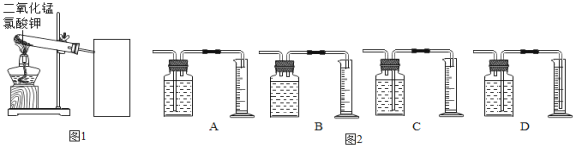
请回答下列问题:
(1)请写出该实验中发生反应的符号表达式:________;
(2)为了完成本实验,方框内应选择图2气体收集装置中的______(填字母);
(3)分析上述数据,你认为利用此法制氧气,二氧化锰与氯酸钾的最佳质量比为_______;
(4)催化剂能影响化学反应速度,温度、反应物的浓度(或质量分数)、反应物接触面积等也会影响化学反应速度。分析上表数据,结合影响化学反应速度的因素分析当二氧化锰与氯酸钾的质量比低于最佳质量比时,反应速度变低的原因是_________。
(二)燃烧镁带,观察现象将镁带打磨光亮,点燃,伸入盛满氧气的集气瓶中,产生大量白烟,生成白色固体。
实验结论:镁与氧气反应生成白色的氧化镁。写出该反应的符号表达式_______
(实验二)镁带与氮气的反应
(一)获取氮气:方法1:工业上把空气液化,然后蒸发,先蒸发出来的气体就是氮气;
方法2:实验室将氨气通过红热的氧化铜,可制得纯净的氮气和铜。属于化学变化的是____(填“方法1”或“方法2”)
(二)燃烧镁带,观察现象
将镁带打磨光亮,点燃,伸入盛氮气的集气瓶中,瓶内壁附着一层淡黄色的固体。
实验结论:镁与氮气在点燃的条件下发生化合反应生成淡黄色的氮化镁,其中氮元素的化合价为-3,则氮化镁的化学式为_______
(实验三)镁带与水蒸气的反应
实验装置如下图所示:
(1)装置A中放入几粒沸石或碎瓷片的目的是__________;
(2)实验开始时,应先点燃A处酒精灯,等观察到水沸腾后,再点燃B处酒精灯,这样做的目的是_______;
(3)生成的气体通入肥皂液中,用燃着的木条靠近肥皂泡,有爆鸣声,稍后有肥皂泡飘到空中,说明生成的气体是_______;
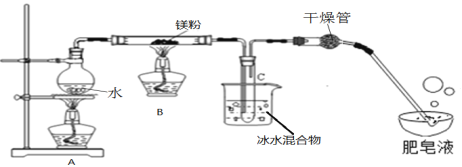
实验结论:镁粉能和水蒸气反应,但装置B中并没有产生黑色固体
(探究结论)根据以上信息,可以推理得出镁在空气中燃烧产生的黑色固体是镁与空气中的_____反应产生的。