题目内容
“宏观辨识与微观探析”是化学学科的核心素养之一。对下列事实或做法的解释正确的是
A. 铁质水龙头表面镀铬可防锈——改变了金属的内部结构
B. 众人拾柴火焰高——可燃物越多,着火点越低,越易燃烧
C. 氧气能被液化贮存于钢瓶——分子间有间隔且间隔能改变
D. 用明矾净水——明矾可降低水中钙、镁离子的含量
下列实验操作能达到实验目的是( )
选项 | 实验目的 | 实验操作 |
A | 鉴别氮气和二氧化碳 | 澄清的石灰水 |
B | 除去CO2中混有的少量CO | 点燃 |
C | 证明蜡烛中含有碳元素 | 将冷碟子压在燃着的蜡烛火焰上 |
D | 除去氧化铜中的碳粉 | 通入一氧化碳,加热 |
A. A B. B C. C D. D
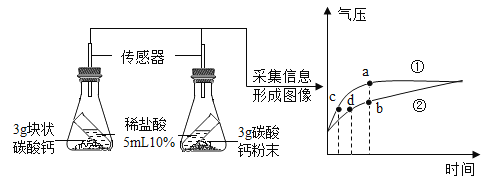
钠是一种活泼金属,常温下能与氧气、水等物质发生反应。钠与水反应的化学方程式为:2Na + 2H2O = 2NaOH + H2↑。在实验室,某同学先取50mL一定质量分数的硫酸铜溶液于烧杯中,再取绿豆大小的钠投入硫酸铜溶液中,充分反应后过滤,得到滤液和蓝色滤渣,并对滤液的成分进行探究。
(查阅资料)Na2SO4溶液呈中性。
(提出猜想)滤液中溶质的成分:I.Na2SO4;II.Na2SO4和NaOH;III._______; IV.Na2SO4、CuSO4和NaOH
其中猜想不合理的是_____,理由是______(用化学方程式表示)。
(实验方案)
实验 | 实验操作 | 实验现象 | 实验结论 |
实验一 | 取少量滤液于试管中,观察现象 | 溶液为无色 | 猜想①___不成立。 |
实验二 | 另取少量滤液于试管中,向其中加入酚酞试液。 | ②____。 | 猜想II不成立。 |
实验三 | 常温下,再取少量滤液,测溶液酸碱度。 | pH=7 | 猜想③____成立。 |
(拓展与思考)
(1)由以上实验可知金属K在与MgCl2等溶液反应时,先跟溶液中的_______反应,所以它_____(填“能”或“不能”)置换出MgCl2溶液中的Mg。
(2)实验室保存金属钠时应注意的是__________。


 液体的倾倒 B.
液体的倾倒 B.  液体的量取
液体的量取 点燃酒精灯 D.
点燃酒精灯 D.  CO2的验满
CO2的验满
