题目内容
【题目】某小组设计如下实验制取二氧化碳并验证其性质(不考虑盐酸的挥发性)。
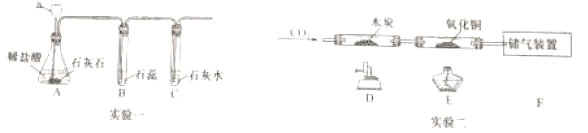
①写出仪器a的名称__。
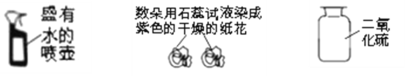
②A中发生反应的化学方程式是___;B中使石蕊变红的物质是__;C装置的作用是__,观察到的现象是__。
③实验二中,先通入二氧化碳一段时间后再加热,目的是__;D处玻璃管中发生反应的化学方程式是__;装置F的作用是___。
④设计实验证明储气装置中的一种气体成分__。
步骤 | 现象及结论 |
___________ | ____________ |
【答案】长颈漏斗 CaCO3+2HCl→CaCl2+H2O+CO2↑ 碳酸 检验CO2 澄清石灰水变浑浊 排尽装置中的空气,防止混合气体加热发生爆炸 CO2+C![]() 2CO 吸收尾气 向储气装置中加入澄清石灰水 有白色沉淀产生 气体中含有 CO2(合理即可)
2CO 吸收尾气 向储气装置中加入澄清石灰水 有白色沉淀产生 气体中含有 CO2(合理即可)
【解析】
①根据实验室常用仪器的名称和题中所指仪器的作用进行分析;
②根据碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,水和二氧化碳反应生成碳酸,碳酸能使紫色石蕊变红色,二氧化碳能使澄清石灰水变浑浊进行分析;
③根据一氧化碳具有可燃性,二氧化碳和碳在高温的条件下生成一氧化碳,一氧化碳有毒进行分析;
④根据二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水进行分析。
①通过分析题中所指仪器的名称和作用可知,a是长颈漏斗;
②碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑,水和二氧化碳反应生成碳酸,碳酸能使紫色石蕊变红色,所以B中使石蕊变红的物质是碳酸,二氧化碳能使澄清石灰水变浑浊,所以C装置的作用是检验二氧化碳,观察到的现象是澄清石灰水变浑浊;
③一氧化碳具有可燃性,实验二中,先通入二氧化碳一段时间后再加热,目的是:排尽装置中的空气,防止混合气体加热发生爆炸,二氧化碳和碳在高温的条件下生成一氧化碳,化学方程式为:CO2+C![]() 2CO,一氧化碳有毒,所以装置F的作用是收集一氧化碳;
2CO,一氧化碳有毒,所以装置F的作用是收集一氧化碳;
④二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水,所以:向储气装置中加入澄清石灰水,澄清石灰水变浑浊,说明含有二氧化碳。

【题目】金属材料与人类的生产、生活息息相关。学习常见金属的性质和金属的活动性顺序,能帮助我们发现和研究更多的金属。
(1)人们习惯上称为“五金”的金、银、铜、铁、锡中,把金属______(填元素符号)的位置移到最后,正好符合金属活动性由_____(填“强到弱”或“弱到强”)的顺序。
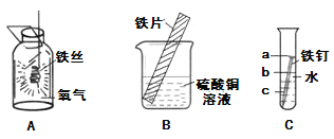
(2)根据上图回答有关问题:
①写出实验A中存在的一处明显错误__________。
②实验B中可观察到铁片的表面_________现象。
③实验C中可观察到试管中铁钉最先生锈的是______处。(填“a”或“b”或“c”)
(3)所谓合金,就是不同种金属(或金属与非金属)在熔化状态下形成的一种熔合物。
Na | Cu | Al | Fe | |
熔点(℃) | 97.5 | 1083 | 660 | 1535 |
沸点(℃) | 883 | 2595 | 2200 | 3000 |
根据上表中四种金属的熔沸点,判断其中不能形成合金的是_______。
a.Cu和Al b.Fe和Cu c.Fe和Na
【题目】在一定条件下,在一个密闭容器内发生某反应,测得反应前后各物质的质量如下表所示,下列说法错误的是( )
物 质 | 氧 气 | 二氧化碳 | 水蒸气 | W |
反应前质量/g | 50 | 1 | 1 | 23 |
反应后质量/g | 2 | 45 | 28 | x |
A. 根据质量守恒定律,x的值应为0 B. 反应后的生成物是二氧化碳和水
C. 物质W含碳、氢、氧三种元素 D. 物质W只含碳和氢两种元素