题目内容
【题目】高锰酸钾(KMnO4)是一种常用化学试剂,主要用于化工、防腐及制药工业等。以软锰矿(主要成分为MnO2)为原料生产高锰酸钾的过程如图所示:
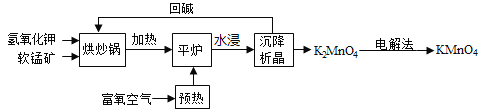
(1)在“烘炒锅”中进行原料混合,发生的是_______________ (填“物理变化”或“化学变化”)。混合前应将软锰矿粉碎,其作用是_______________。
(2)在平炉中发生反应得到K2MnO4,参加反应的物质有_______________。
(3)电解法得到高锰酸钾的化学方程式为![]() 。该反应前后化合价发生改变的元素有_______________。
。该反应前后化合价发生改变的元素有_______________。
【答案】物理变化 增大反应物接触面积,使反应更快更充分 MnO2、KOH、O2 锰(Mn)、氢(H)
【解析】
(1)在“烘炒锅”中进行原料混合,只是混合在一起,没有新物质生成,属于物理变化;混合前应将软锰矿粉碎,其目的是增大反应物接触面积,使反应更快更充分;
(2)由以软锰矿(主要成分为MnO2)为原料生产高锰酸钾的流程图,在平炉中发生反应得到K2MnO4,参加反应的物质有MnO2、KOH、O2。
(3)K2MnO4中,钾元素显+1价,氧元素显-2价,设K2MnO4中锰元素的化合价为x,根据化合物中各元素的化合价代数和为零,则有:(+1)×2+x+(-2)×4=0,x=+6;KMnO4中,钾元素显+1价,氧元素显-2价,设KMnO4中锰元素的化合价为y,根据化合物中各元素的化合价代数和为零,则有:(+1) +y+(-2)×4=0,y=+7;水中氧元素显-2价,根据化合物中各元素的化合价代数和为零可知,氢元素显+1价,氢气中氢元素为0价。电解法得到高锰酸钾的化学方程式为![]() 。该反应前后化合价发生改变的元素有锰(Mn)、氢(H)。
。该反应前后化合价发生改变的元素有锰(Mn)、氢(H)。

 名校课堂系列答案
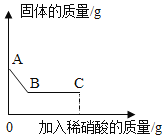
名校课堂系列答案【题目】为了探究催化剂种类对氯酸钾分解速度的影响,某兴趣小组在相同的加热条件下以生成等体积的氧气为标准,设计了下列四组实验:
试验编号 | 氯酸钾质量/g | 催化剂 | 催化剂质量/g | 收集50mL氧气所需时间/s |
1 | 5 | _____ | _____ | 171 |
2 | X | 二氧化锰 | 0.5 | 49 |
3 | 5 | 氧化铁 | 0.5 | 58 |
4 | 5 | 氯化钾 | 0.5 | 154 |
(1)写出氯酸钾在二氧化锰的催化作用下发生反应的文字表达式_____。
(2)实验②中,X的值为_____对比实验②和实验③,可以得出的结论是:_____的催化效果更好。
(3)对比实验①和实验④可知氯化钾_____(填“有”或“无”)催化作用。维持加热条件不变,用实验①再继续收集50mL氧气,所需时间明显小于171s,原因是_____。
(4)要比较催化剂种类对氯酸钾分解速度的影响,除了测量收集50mL氧气所需的时间,还可以测量_____。
【题目】某兴趣小组对酸碱中和反应进行了如下探究。请回答相关问题。
I.探究酸和碱能否发生反应
方案l:甲同学向盛有少量NaOH溶液的试管中滴几滴无色酚酞试液,振荡,继续加入稀硫酸,观察到溶液由______色变成无色。甲同学得出结论:酸和碱能发生反应。请写出稀硫酸和氢氧化钠溶液反应的化学方程式________。
方案2:乙同学取少量NaOH溶液,测得溶液pH为10,向该溶液中加入一定量稀硫酸后,测得溶液pH为9,乙同学发现溶液pH减小了,得出结论:酸和碱能发生反应。
交流讨论:大家同意甲同学的结论,对乙同学的实验过程提出质疑,溶液pH减小的原因还可能是稀硫酸中的水稀释了NaOH溶液;大家认为,乙同学向NaOH溶液中加入稀硫酸后,测得溶液的pH必须________(填“小于”或“小于或等于”)7,才能证明酸和碱能发生反应。
II.探究酸和碱反应后溶液中溶质的成分
丙同学对探究I中甲同学实验后的无色溶液展开探究。
(提出问题)试管中无色溶液的溶质除了酚酞还有什么?
(提出猜想)(l)Na2SO4;(2)______。
(设计实验)
实验操作 | 实验现象 | 实验结论 | |
方案I | 向试管中加入少量锌粒,然后加入甲同学实验后的无色溶液 | 锌粒逐渐减少,有_______产生 | 猜想(2)成立 |
方案II | 向试管中加入少量甲同学实验后的无色溶液,然后慢慢滴加NaOH溶液,并不断振荡试管 | 开始无明显现象,过一会发现______。 |
(实验反思)为了验证猜想(2)成立,你认为还可以选择的药品是____(填字母序号)。
A BaCl2溶液 B Cu C Fe2O3 D Cu(OH)2