题目内容
【题目】钔是一种重要的金属元素,在元素周期表中的相关信息如下图所示。下列有关说法正确的是( )
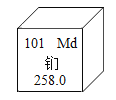
A.钔元素的原子核外有 157 个电子
B.钔单质的化学式为 Md
C.钔在化学反应中易得电子
D.钔的相对原子质量为 258.0g
【答案】B
【解析】
在元素周期表的一格中,左上角是原子序数,在数值上等于质子数=核电荷数=核外电子数,右上角是元素符号,中间是元素名称,从名称可以得出元素是金属元素还是非金属元素,金属元素的原子在化学反应中一般失去电子,最下面是相对原子质量,单位为“1”,一般不写。
A、根据元素周期表中的一格可知,左上角的数字为101,表示原子序数为101;根据原子中,原子序数=核电荷数=质子数=核外电子数,则素的原子核外有101个电子,故选项说法错误。
B、钔属于金属元素,其化学式直接用元素符号表示,所以钔单质的化学式为Md,故选项说法正确。
C、钔属于金属元素,金属元素的原子在化学反应中一般失去电子,故选项说法错误。
D、根据元素周期表中的一格可知,汉字下面的数字表示相对原子质量,该元素的相对原子质量为258.0,单位为“1”,一般不写,故选项说法错误。
故选:B。

【题目】现有一包黑色固体粉末,可能含有炭粉、CuO、Fe3O4中的两种或者三种,某化学兴趣小组通过实验探究其成分。
(1)提出问题:该黑色固体粉末成分是什么?
(2)作出猜想:
猜想一:混合固体是炭粉、CuO
猜想二:混合固体是炭粉、Fe3O4
猜想三:混合固体是_____(物质写不去不给分)
猜想四:混合固体是炭粉、CuO、Fe3O4
(3)查阅资料:Fe3O4为黑色粉末,能与盐酸反应,含有Fe3+的盐溶液遇到KSCN(硫氰化钾)溶液时变成红色,Fe(OH)2是一种白色沉淀。
(4)实验探究:取一定量的固体于试管中,加足量的盐酸,充分反应后有部分固体溶解,过滤,得到滤液A,并对滤液A的成分进行如下探究:
实验操作 | 实验现象 | 实验结论 |
步骤一:取一定量滤液A于试管中,加入足量的铁粉 | 无红色固体析出 | 该固体物质一定没有_____ |
步骤二:又取一定量的滤液A于试管中,加入少量的KSCN(硫氰化钾)溶液 | 溶液变成红色 | 滤液A中一定含有的物质是_____ |
步骤三:再取一定量的滤液A于试管中,加入足量的NaOH溶液 | 有红褐色沉淀生成,同时还有少量的白色沉淀生成,白色沉淀迅速变成灰绿色,最后变成红褐色 | 滤液A中还一定含有的物质是_____ |
(5)讨论交流:
①通过以上实验,猜想_____成立。
②写出Fe3O4与盐酸反应的化学方程式:_____。
③四氧化三铁作为铁的一种氧化物,在高温下还能被单质铝还原,同时生成一种稳定的氧化物,请你写出该反应的化学方程式:_____。
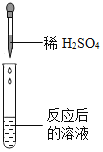
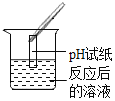
【题目】碳酸氢钠是小苏打的主要成分,在生产和生活中有许多重要的用途。化学课上,同学们为了解碳酸氢钠的性质,将一定质量的碳酸氢钠和稀硫酸混合,充分反应后,有气体逸出,写出该反应的化学方程式______ ,同学们对反应后溶液中溶质的成分进行了探究:认为除一定含有硫酸钠外可能还含有其他成分,因此进行了猜想并做了如下实验:
(实验用品)pH试纸、稀硫酸、氢氧化钠溶液、氯化钡溶液。
(猜想与假设)反应后溶液总溶质的可能组成成分。
猜想一:硫酸钠
猜想二:硫酸钠、碳酸氢钠
猜想三:硫酸钠、硫酸
(实验探究)同学们取反应后的溶液用不同方案进行如下实验,请根据结论完成如表实验现象中的空格。
实验方案 | A | B | C |
实验操作 |
|
|
|
实验现象 | 无明显现象 | 产生白色沉淀 | 试纸变色,对照标准比色卡, pH ______ 7 |
实验结论 | 猜想二不正确 | 猜想三正确 | 猜想三正确 |
(得出结论)猜想三正确。
(评价反思)
(1)老师对同学们能用多种方案进行探究,并且得出正确的实验结论给予了肯定,同时指出探究中存在一处明显错误是:______。
(2)小明同学对实验方案B的结论提出了质疑,认为仅凭此现象不能得出猜想三正确,请说明理由:______。
(拓展应用)
(3)小明同学用______代替BaCl2溶液,同样得出猜想三是正确的。