题目内容
【题目】聚合硫酸铁(PFS)是一种新型的饮用水处理剂和城市污水净化剂,其化学组成可表示为[Fex(OH)y(SO4)z]m . 某中学化学兴趣小组以聚合硫酸铁的生产流程和相关性质进行了一系列的探究. Ⅰ.聚合硫酸铁的工业生产.
如图是以回收废铁屑为原料制备PFS的一种工艺流程.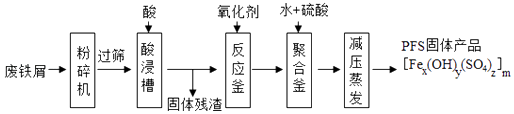
回答下列问题
(1)废铁屑主要为表面附有大量铁锈的铁,铁锈的主要成分为 . “过筛”与化学实验中的原理相似(填操作名称).
(2)酸浸时最合适的酸是 , 写出铁锈与该酸反应的化学反应方程式 .
(3)反应釜中加入氧化剂的作用是将Fe2+转化为Fe3+ . 你认为下列氧化剂中最合适的是(填标号),原因是 . A.KMnO4B.Cl2C.H2O2D.HNO3
(4)相对于常压蒸发,减压蒸发的优点是 .
A.有利于水分蒸发
B.降低沸点,防止晶体分解
C.降低生产成本
(5)Ⅱ.聚合硫酸铁的成分探究. 该研究小组为确定聚合硫酸铁的化学式,进行了如下实验:
①称取5.52g聚合硫酸铁样品溶于足量的稀盐酸中并充分混合;
②向①所得的混合物中加入足量的BaCl2溶液,充分反应后,经过滤、洗涤、干燥、称重,得沉淀4.66g.
③若向步骤②的滤液中加入过量的NaOH溶液,充分反应后,再将沉淀过滤、洗涤、灼烧、称重,得固体3.20g.
则聚合硫酸铁[Fex(OH)y(SO4)z]m样品中的x:y:z的值为 .
试写出该聚合硫酸铁与盐酸的反应方程式 .
(6)Ⅲ.聚合硫酸铁的热分解气体产物成分探究. 该小组将5.52g聚合硫酸铁在一定条件下加热完全分解,对所得气体产物进行实验探究.(已知SO3的熔点为16.8℃).
【提出假设】
假设1:所得气体的成分是SO3;
假设2:所得气体的成分是SO2、O2;
假设3:所得气体的成分是 .
(7)【设计实验】 按下图装置进行实验.
实验过程中发现:B中无水硫酸铜变蓝,C中U形管内有无色晶体析出,D中品红溶液褪色,装置E的作用是 .
【实验结论】
通过实验现象判断,假设成立.
如果最终试管中固体为一种红棕色纯净物,则质量为 .
【答案】
(1)氧化铁;过滤
(2)稀硫酸;Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
(3)C;不引入其他杂质
(4)AB
(5)2:4:1;3[Fe2(OH)4SO4]m+12mHCl=mFe2(SO4)3+4mFeCl3+12mH2O
(6)SO3、SO2、O2
(7)吸收多余的二氧化硫,防止污染空气;3;3.2
【解析】解:Ⅰ.(1)铁锈的主要成分是氧化铁,“过筛”与化学实验中的过滤原理相似. 故填:氧化铁;过滤.(2)酸浸时最合适的酸是稀硫酸,这样可以防止带入新的杂质;
铁锈中的氧化铁与稀硫酸反应生成硫酸铁和水,反应的化学反应方程式为:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O.
故填:稀硫酸;Fe2O3+3H2SO4=Fe2(SO4)3+3H2O.(3)反应釜中加入氧化剂的作用是将Fe2+转化为Fe3+ , 下列氧化剂中最合适的是H2O2 , 这是因为利用过氧化氢做氧化剂不会带入新的杂质.
故选:C.(4)相对于常压蒸发,减压蒸发有利于水分蒸发,能够降低沸点,防止晶体分解.
故选:AB.Ⅱ.设硫酸根离子质量为x,
Ba2++ | SO42﹣= | BaSO4 , |
96 | 233 | |
x | 4.66g |
![]() =
= ![]() ,
,
x=1.92g,
若向步骤②的滤液中加入过量的NaOH溶液,充分反应后得到氢氧化铁沉淀,再将沉淀过滤、洗涤、灼烧得到氧化铁、称重,得固体3.20g,说明氧化铁质量是3.20g,则铁离子质量为:3.20g ![]() ×100%=2.24g,
×100%=2.24g,
则聚合硫酸铁中氢氧根离子质量为:5.52g﹣1.92g﹣2.24g=1.36g,
x:y:z= ![]() :
: ![]() :
: ![]() =2:4:1.
=2:4:1.
故填:2:4:1.
该聚合硫酸铁与盐酸的反应方程式为:3[Fe2(OH)4SO4]m+12mHCl=mFe2(SO4)3+4mFeCl3+12mH2O.
故填:3[Fe2(OH)4SO4]m+12mHCl=mFe2(SO4)3+4mFeCl3+12mH2O.Ⅲ.【提出假设】
假设1:所得气体的成分是SO3;
假设2:所得气体的成分是SO2、O2;
假设3:所得气体的成分是 SO3、SO2、O2 .
故填:SO3、SO2、O2 .
【设计实验】装置E的作用是吸收多余的二氧化硫,防止污染空气.
故填:吸收多余的二氧化硫,防止污染空气.
B中无水硫酸铜变蓝说明生成水,C中U形管内有无色晶体析出是在冰水结晶的,根据信息“已知SO3的熔点为16.8℃”,可知晶体为三氧化硫,D中品红溶液褪色,说明生成二氧化硫,所以应该是假设3成立.
如果最终试管中固体为一种红棕色纯净物,根据颜色以及质量守恒定律可得固体为氧化铁.
设生成的氧化铁的质量为x(这个化学方程式配平可以用待定系数法,最好是借助化合价升降法)
4Fe2(OH)4SO4 | 4Fe2O3+2SO2↑+2SO3↑+O2↑+8H2O |
1104 | 640 |
5.52g | x |
![]() =
= ![]()
x=3.2g
故填:3;3.2g
【考点精析】本题主要考查了铁锈的主要成分和书写化学方程式、文字表达式、电离方程式的相关知识点,需要掌握铁生锈的条件是:铁与O2、水接触(铁锈的主要成分:Fe2O3XH2O);注意:a、配平 b、条件 c、箭号才能正确解答此题.

 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案