题目内容
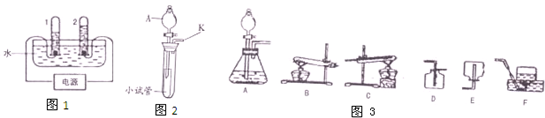
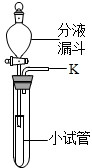
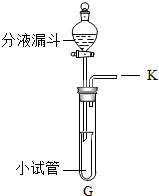
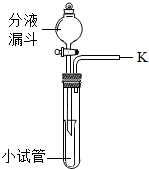
同学们在课外活动中设计了有关气体的实验.(1)气体的发生装置如图所示.
①此装置若用于制备氧气,应在分液漏斗中盛放的药品是______;
②若用于制备二氧化碳,反应的化学方程式是______.
此装置还可以验证某气体的化学性质,请完成下表中的内容.
| 仪器名称 | 分液漏斗 | 小试管 | 大试管 |
| 装置内的药品 | ______ | 大理石 | ______ |
| 用化学方程式表示相关性质 | ______ | ||
(2)同学们又设计以下实验研究某混合气体的组成.
①第一组:取三支试管,在其容积的二分之一处做标记.分别充满气体(甲为CO2,乙为A
气体,丙为CO2和A的混合气)后倒扣在NaOH溶液中.最终观察到的实验现象如图所示.
据此推测:气体A的化学性质有______.

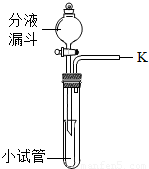
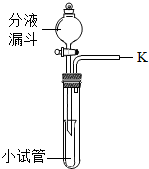
②第二组:同学们利用如图所示的装置进行实验.
实验步骤:关闭止水夹,向充满丙的集气瓶中注入10mLNaOH溶液(足量),充分反应后,冷却至室温,打开止水夹.实验现象是______.

【答案】分析:(1)①制取氧气的药品是过氧化氢溶液和二氧化锰;②实验室通常用稀盐酸与大理石(或石灰石)反应制取二氧化碳,碳酸钙与盐酸反应生成氯化钙、水和二氧化碳,写出反应的方程式;可以通过紫色的石蕊试液检验二氧化碳能够和水反应生成酸,能够使澄清的石灰水变浑浊;③可以在导管口检验二氧化碳不能燃烧也不能支持燃烧的性质;
(2)①甲试管中氢氧化钠溶液进入并充满试管,说明氢氧化钠被消耗掉,丙试管中液体进入试管体积的一半,结合甲试管和丙试管中的现象联系二氧化碳的性质可以完成该题的解答;
②利用丙气体中二氧化碳占其中的二分之一的知识解决.
解答:解:(1)①制取氧气的药品是过氧化氢溶液和二氧化锰,应在分液漏斗中盛放的药品是过氧化氢溶液;
②实验室通常用稀盐酸与大理石(或石灰石)反应制取二氧化碳,碳酸钙与盐酸反应生成氯化钙、水和二氧化碳,反应的方程式:CaCO3+2HCl=CaCl2+H2O+CO2↑;可以通过紫色的石蕊试液检验二氧化碳能够和水反应生成酸,反应的方程式为:CO2+H2O═H2CO3,也能够使澄清的石灰水变浑浊,反应的方程式为:CO2+Ca(OH)2=CaCO3↓+H2O;
③可以在导管口检验二氧化碳不能燃烧也不能支持燃烧的性质;
(2)①甲试管氢氧化钠溶液进入并充满试管,说明氢氧化钠溶液可以和二氧化碳反应,丙试管中液体进入试管体积的一半,说明二氧化碳和消耗氢氧化钠溶液的体积为1:1,而乙试管中的A气体氢氧化钠溶液未进入,说明氢氧化钠没有被消耗掉,也就是没有反应.即A气体不与氢氧化钠溶液反应(或不与氢氧化钠、水、二氧化碳反应);
②由①的实验可以看出:丙气体中二氧化碳占其中的二分之一,即广口瓶中二氧化碳的体积为125mL,所以加入10mL溶液后进入氢氧化钠溶液后要消耗10mL二氧化碳气体,此时盛有气体的广口瓶内外产生了一个压强差,从而使水进入到广口瓶中,直至把二氧化碳完全消耗,即进入广口瓶的体积应为125mL-10mL=115mL,量筒中余下的水为85mL.
故答案为:(1)①过氧化氢溶液;CaCO3+2HCl=CaCl2+CO2↑+H2O
②稀盐酸;石灰水(或紫色石蕊试液);
CO2+Ca(OH)2=CaCO3↓+H2O(或CO2+H2O═H2CO3)
③将一根燃着的木条放在K处
(2)①不与氢氧化钠溶液(或氢氧化钠、水)反应;
②有115mL的水倒吸入集气瓶中(或水倒吸入集气瓶,量筒中余下的水为85mL)
点评:此题是一道常见气体的制取、收集、性质及实验推断题,解题的关键是把握制取气体的原理、装置的选择、气体的性质及依据现象对装置及结论作出判断,并利用结论对其进行分析.
(2)①甲试管中氢氧化钠溶液进入并充满试管,说明氢氧化钠被消耗掉,丙试管中液体进入试管体积的一半,结合甲试管和丙试管中的现象联系二氧化碳的性质可以完成该题的解答;
②利用丙气体中二氧化碳占其中的二分之一的知识解决.
解答:解:(1)①制取氧气的药品是过氧化氢溶液和二氧化锰,应在分液漏斗中盛放的药品是过氧化氢溶液;
②实验室通常用稀盐酸与大理石(或石灰石)反应制取二氧化碳,碳酸钙与盐酸反应生成氯化钙、水和二氧化碳,反应的方程式:CaCO3+2HCl=CaCl2+H2O+CO2↑;可以通过紫色的石蕊试液检验二氧化碳能够和水反应生成酸,反应的方程式为:CO2+H2O═H2CO3,也能够使澄清的石灰水变浑浊,反应的方程式为:CO2+Ca(OH)2=CaCO3↓+H2O;
③可以在导管口检验二氧化碳不能燃烧也不能支持燃烧的性质;
(2)①甲试管氢氧化钠溶液进入并充满试管,说明氢氧化钠溶液可以和二氧化碳反应,丙试管中液体进入试管体积的一半,说明二氧化碳和消耗氢氧化钠溶液的体积为1:1,而乙试管中的A气体氢氧化钠溶液未进入,说明氢氧化钠没有被消耗掉,也就是没有反应.即A气体不与氢氧化钠溶液反应(或不与氢氧化钠、水、二氧化碳反应);
②由①的实验可以看出:丙气体中二氧化碳占其中的二分之一,即广口瓶中二氧化碳的体积为125mL,所以加入10mL溶液后进入氢氧化钠溶液后要消耗10mL二氧化碳气体,此时盛有气体的广口瓶内外产生了一个压强差,从而使水进入到广口瓶中,直至把二氧化碳完全消耗,即进入广口瓶的体积应为125mL-10mL=115mL,量筒中余下的水为85mL.
故答案为:(1)①过氧化氢溶液;CaCO3+2HCl=CaCl2+CO2↑+H2O
②稀盐酸;石灰水(或紫色石蕊试液);
CO2+Ca(OH)2=CaCO3↓+H2O(或CO2+H2O═H2CO3)
③将一根燃着的木条放在K处
(2)①不与氢氧化钠溶液(或氢氧化钠、水)反应;
②有115mL的水倒吸入集气瓶中(或水倒吸入集气瓶,量筒中余下的水为85mL)
点评:此题是一道常见气体的制取、收集、性质及实验推断题,解题的关键是把握制取气体的原理、装置的选择、气体的性质及依据现象对装置及结论作出判断,并利用结论对其进行分析.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 同学们在课外活动中设计了有关气体的实验.气体的发生装置如图所示.
同学们在课外活动中设计了有关气体的实验.气体的发生装置如图所示.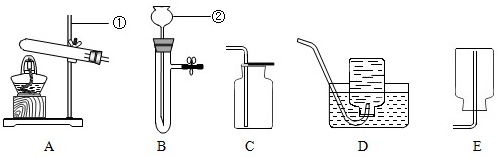
 同学们在课外活动中设计了有关气体的实验.气体的发生装置如图所示.
同学们在课外活动中设计了有关气体的实验.气体的发生装置如图所示.