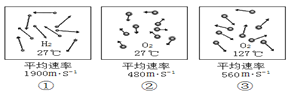
��Ŀ����
����Ŀ�������ܽ���ѧϰ��ѧ����Ҫ������С��ͬѧ��ͼһ�ܽ��������������ѧ����(�����������������ܹ�������ѧ��Ӧ)��
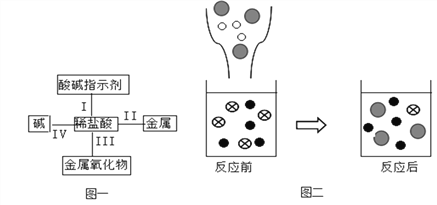
(1)��֤����I��С����ʯ����Һ����ϡ�����У�������________________��
(2)��֤����II������ϡ���ᷴӦ��������______________(�����)��
A��Mg B��Fe2O3 C��Al D��Au
(3)��֤����IV��С��������������Һ�еμ�ϡ���ᡣ
�ٸ÷�Ӧ�Ļ�ѧ����ʽ��_____________________��
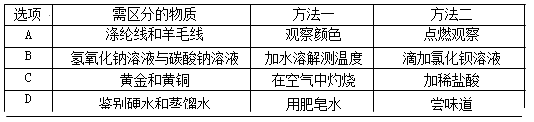
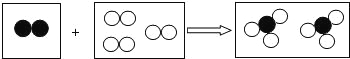
��ͼ����ʾ�÷�Ӧǰ����Һ�д��ڵ���Ҫ���ӣ���д������ͼ�δ���������(�����ӷ���)�� ![]() _____________��
_____________��![]() ______________��
______________��
�۴�ͼ���п��Կ�������Ӧ�����ҺpH______7(�� ������������������=��)��
���𰸡� ��Һ���ɫ A C KOH + HCl=KCl +H2O K+ Cl- >
�����������⿼������Ļ�ѧ���ʣ���Һ���������pHֵ�Ĺ�ϵ���кͷ�Ӧ��ʵ�ʣ���ѧ����ʽ����д�ȡ�
��1��ʯ����Һ��Һ��������Һ�ʺ�ɫ����֤����Iʱ��С����ʯ����Һ����ϡ������ʱ��ϡ���������ԣ���ʹʯ����Һ���ɫ��
��2������II����������ķ�Ӧ����֤����IIʱ������ϡ���ᷴӦ�Ľ���������þ������ϡ�����þ��Ӧ�����Ȼ�þ��������������Ӧ�����Ȼ�������������ѡAC��
��3�����������غ�ϡ���ᷴӦ�����Ȼ��غ�ˮ���÷�Ӧ�Ļ�ѧ����ʽ�ǣ�KOH+HCl�TKCl+H2O��
���������غ�ϡ���ᷴӦʱ�������Ӻ����������ӽ������ˮ�������![]() ����ʾK+�� ��
����ʾK+�� ��![]() ����ʾCl����
����ʾCl����
�۴�ͼ���п��Կ�������Ӧ�����������ع�������Һ�Լ��ԣ�pH��7��

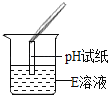
����Ŀ����ѧ��ȤС��ͬѧ����ʵ��̨�ϰ���ͼ��ʾ˳��ڷ���6ƿ��ͬ����ɫ��Һ(��ͼ��ʾ��A��B��C��D��E��F������Ӧ����Һ)������E��Һ���Լ�ƿ��ǩ����Ϊ�ˣ�������������̽����
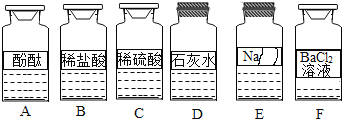
��������⡿E��Һ�ijɷ���ʲô��
�������жϡ����������ǩ��ʵ����ҩƷ����ڷ�ԭ��E��Һ��������_______(�����)����ڼ���������
��������롿
�������NaOH��Һ��
�������Na2CO3��Һ��
�������Na2SO4��Һ���������____��Һ(��дһ��)��
��Ʋ�ʵ����ȤС���ͬѧΪ��֤����������Ƿ���ȷ����Ʋ�������±���ʾʵ����
ʵ�鷽�� | ʵ��һ | ʵ��� | ʵ���� |
ʵ����� |
|
|
|
ʵ������ | ��ֽ��ɫ�����ձ�ɫ����pH��7 | ����ɫ��ζ������� | _____________�� �� |
ʵ����� | �������ȷ | ||
��������������
�������ʵ��һ�������ͬѧ����Ϊ�����������ȷ����ƽͬѧ��Ϊ�����������һ����ȷ������������_________________________��
����д����ʵ�������з�����Ӧ�Ļ�ѧ����ʽ___________________________��
����˼�����ۡ�
�������ۣ�ͬѧ����Ϊʵ���д������Բ������ô�����___________________��