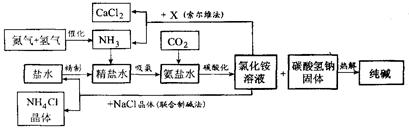
题目内容
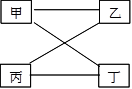
(1)若C为厨房内常用的调味品;在A溶液中加入铁粉能产生氢气,则A是 .
若A、B两溶液恰好反应完全,则反应后溶液的PH 7(填“<”、“>”或“=”);写出A、B两溶液反应的化学方程式 .
(2)若B常用来改良酸性土壤;D是重要的化工原料且与B的类别相同;B与CO2反应也能生成C;则A为 .C的用途是(只要写一种) .写出B溶液与CO2反应的化学方程式 .
若A、B两溶液恰好反应完全,则反应后溶液的PH 7(填“<”、“>”或“=”);写出A、B两溶液反应的化学方程式 .
(2)若B常用来改良酸性土壤;D是重要的化工原料且与B的类别相同;B与CO2反应也能生成C;则A为 .C的用途是(只要写一种) .写出B溶液与CO2反应的化学方程式 .
(1)稀盐酸;=;HCl+NaOH═NaCl+H2O;
(2)Na2CO3;建筑材料(合理即可);CO2+Ca(OH)2=CaCO3↓+H2O;
(2)Na2CO3;建筑材料(合理即可);CO2+Ca(OH)2=CaCO3↓+H2O;
(1)C为厨房内常用的调味品可猜测C是食盐,在A溶液中加入铁粉能产生氢气说明是一种酸,依据C可能是食盐,所以该酸可能是稀盐酸,此时B应该是氢氧化钠,因为盐酸和氢氧化钠反应能生成氯化钠,且符合A+B→C+D的形式,故猜测正确,当盐酸和氢氧化钠恰好反应时会生成氯化钠和水,此时溶液呈中性pH=7,方程式为:HCl+NaOH═NaCl+H2O;
(2)B常用来改良酸性土壤,可知B是氢氧化钙,D是重要的化工原料且与B的类别相同,说明D是一种碱,氢氧化钙与二氧化碳反应可生成碳酸钙和水,所以C是碳酸钙,则A是碳酸钠,D是氢氧化钠,符合A+B→C+D且与叙述情况相符,碳酸钙是重要的建筑材料(合理即可),氢氧化钙与二氧化碳反应方程式为:CO2+Ca(OH)2=CaCO3↓+H2O
(2)B常用来改良酸性土壤,可知B是氢氧化钙,D是重要的化工原料且与B的类别相同,说明D是一种碱,氢氧化钙与二氧化碳反应可生成碳酸钙和水,所以C是碳酸钙,则A是碳酸钠,D是氢氧化钠,符合A+B→C+D且与叙述情况相符,碳酸钙是重要的建筑材料(合理即可),氢氧化钙与二氧化碳反应方程式为:CO2+Ca(OH)2=CaCO3↓+H2O

练习册系列答案
相关题目
 ="=" NH3↑+HCl↑
="=" NH3↑+HCl↑