题目内容
【题目】硫酸铜在纺织、印刷等行业有广泛用途。
(1)工业上可用铜屑、空气与稀硫酸在80℃条件下制备硫酸铜。
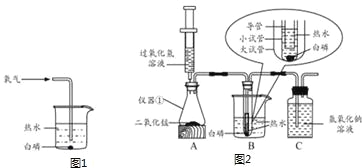
①如图1是实验室模拟工业制备硫酸铜的装置,反应的化学方程式为 ,采用水浴加热的优点是 ,多孔球泡的作用为 。

②工业生产时可用纯氧代替空气。这一措施能加快反应速率外,还具有的优点是 。
③实验室用H2O2溶液和MnO2制备O2,反应的化学方程式为 ,在图2中,应选用的发生装置为 (填序号,下同),收集装置为 。
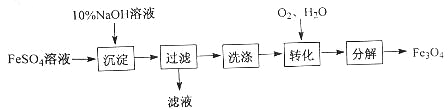
(2)以CuSO4为原料制备碱式碳酸铜[Cu2(OH)2CO3]的过程如图3:
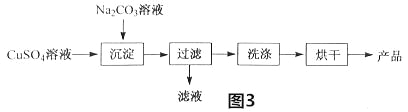
①“沉淀”时的反应为:2CuSO4+2Na2CO3+H2O=Cu2(OH)2CO3↓+2 +CO2↑
②检验沉淀是否洗涤干净选用的试剂是 (填化学式),烘干时产品中出现少量黑色物质,可能的原因为 。
③若所得产品的产率(产率=![]() ×100%)偏高,其可能的原因为 (填序号)。
×100%)偏高,其可能的原因为 (填序号)。
a.反应物为完全沉淀
b.过滤时滤纸破损
c.Cu2(OH)2CO3未洗涤干净
d.Cu2(OH)2CO3为完全烘干
④“沉淀”时若有少量3Cu(OH)22CuSO4生成,则产品中铜元素的质量分数 。(填“偏大”“不变”或“偏小”)
(3)T℃时加热32.0g硫酸铜,一段时间后得到15.2gCuO和Cu2O的混合物,计算该混合物中CuO的质量(写出计算过程)。
【答案】
(1)①2Cu+O2+2H2SO4![]() 2CuSO4+2H2O
2CuSO4+2H2O
温度易控,受热均匀
增大气体与溶液的接触面积,使反应充分进行
②排除其他气体的干扰;
③2H2O2![]() 2H2O+O2↑ A D
2H2O+O2↑ A D
(2)①Na2SO4
②HNO3和BaCl2溶液 碱式碳酸铜受热分解为氧化铜
③c
④不变
(3)0.7g
【解析】
试题分析:
(1)①铜、氧气和硫酸在加热的条件下反应生成硫酸铜和水,化学方程式为:2Cu+O2+2H2SO4![]() 2CuSO4+2H2O。直接加热温度过高,反应温度难以控制,水浴加热,反应的温度很好控制,受热均匀,图中多孔球泡的作用是:增大气体与溶液的接触面积,使反应充分进行。
2CuSO4+2H2O。直接加热温度过高,反应温度难以控制,水浴加热,反应的温度很好控制,受热均匀,图中多孔球泡的作用是:增大气体与溶液的接触面积,使反应充分进行。
②工业生产时可用纯氧代替空气。这一措施能加快反应速率外,还具有的优点是排除其他气体的干扰;
③用双氧水制氧气应选用的制取装置是固液常温型,收集方法可以是排水法也可是向上排空气法,反应的化学方程式为:2H2O2![]() 2H2O+O2↑。
2H2O+O2↑。
(2)①反应前有2个铜原子、2个硫原子、15个氧原子、2个碳原子、4个钠原子和2个氢原子,反应后2个铜原子、0个硫原子、7个氧原子、2个碳原子、0个钠原子和2个氢原子,依据化学反应前后原子的种类和个数不变可知,2X中有4个钠原子、2个硫原子、8个氧原子,所以X化学是为Na2SO4;
②故检验沉淀是否洗涤干净,可检验硫酸根离子的存在,应选用试剂是 HNO3和BaCl2溶液;烘干时产品中出现少量黑色物质,可能的原因为碱式碳酸铜受热分解为氧化铜;
③若所得产品的产率(产率=![]() ×100%)偏高,其可能的原因为:a、反应物为完全沉淀,无影响;b、过滤时滤纸破损,产品的实际质量减少,所得产品的产率降低;c、Cu2(OH)2CO3未洗涤干净 产品的实际质量增大,所得产品的产率偏高;d、Cu2(OH)2CO3为完全烘干,无影响;
×100%)偏高,其可能的原因为:a、反应物为完全沉淀,无影响;b、过滤时滤纸破损,产品的实际质量减少,所得产品的产率降低;c、Cu2(OH)2CO3未洗涤干净 产品的实际质量增大,所得产品的产率偏高;d、Cu2(OH)2CO3为完全烘干,无影响;
④“沉淀”时若有少量3Cu(OH)22CuSO4生成,则产品中铜元素的质量分数不变;
(3)反应前后铜元素的质量相等,
设该混合物中CuO的质量为x,则Cu2O的质量=15.2g﹣x
32g×![]() =x×
=x×![]() 100%+(15.2g﹣x)×
100%+(15.2g﹣x)×![]() ×100%
×100%
x=0.7g。