题目内容
(1)“爆竹声中一岁除”燃放烟花爆竹是中华民族文化的重要组成部分,然而,近年灰我国许多大、中城市都对烟花爆竹实施了“禁放“或者”限放“,民族文化为什么受到限制,好奇心驱使小明,小强、小亮三位同学,他们决定对烟花爆竹进行展开实验探究.
[提出问题]烟花爆竹燃放时会产生什么气体?
[查阅资料]我国传统的黑火药的标准配方为:硝酸钾75%、硫磺l0%、木炭l5%,因为黑火药中的硫磺成分具有着火温度低、燃速快等性质,因而使黑火药容易点火,使得在生产过程中硫的使用量过大.
(2)CO2和SO2均能使石灰水变浑浊;
[猜想]烟花爆竹燃放时会产生CO2和SO2
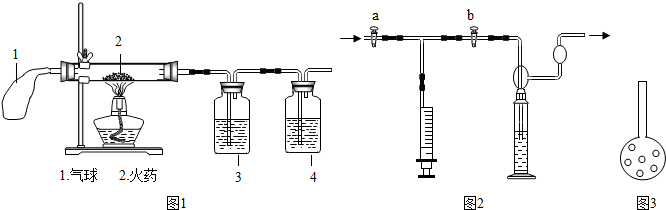
[实验过程]他们设计的实验探究过程如图1实验开始前应先检查______,再点燃酒精灯,已知2处为从爆竹中取出的少量的火药,根据实验设计要求应当还要用到______色的高锰酸钾溶液和石灰水,则3中应放的是______,4中应放的是______,若猜想正确,4中发生反应的化学方程式是______.结果证明原猜想正确,
[实验反思]
(1)装置中气球的作用是______,
(2)已知 硬质玻璃管中发生的反应有S+2KNO3+3C═3CO2+N2+X,则X的化学式为______.该玻璃管中还发生的反应______ SO2
【答案】分析:[实验过程]根据该装置需要气密性较好的要求判断开始时的操作,根据高锰酸钾溶液能被二氧化硫褪色,以及二氧化碳能使石灰水变浑浊分析解答;
[实验反思](1)根据该反应进行时较剧烈容易导致装置内气压偏大分析气球的作用;
(2)根据质量守恒定律的应用以及该反应的产物中还含有二氧化硫分析解答此题;
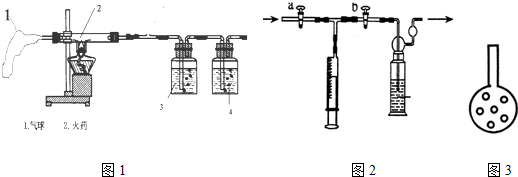
[测定步骤]:
(二)二氧化硫含量的测定
(3)根据次数越少说明反应越充分的原理判断那一次的反应更充分一些;
[测定反思](1)根据接触面积越大反应越充分分析多孔球泡的作用;
(2)根据碘液的质量决定消耗的气体量分析解答;
(3)根据燃放烟花爆竹的产物分析燃放烟花爆竹的危害;
解答:解:[实验过程]由于该装置需要气密性较好,所以首先对该装置要进行气密性检查的处理,由于二氧化硫具有漂白作用能使紫红色高锰酸钾溶液褪色,且二氧化硫、二氧化碳均能使石灰水变浑浊,所以应首先检验二氧化硫,而后利用二氧化碳能使石灰水变浑浊的特征检验二氧化碳;
[实验反思](1)由于该反应进行时较剧烈容易导致装置内气压偏大,所以放上气球可有效地对装置内的压强起到缓冲作用;
(2)根据质量守恒定律可知反应前后各原子的种类及个数不变,S+2KNO3+3C═3CO2+N2+X中反应前硫原子、钾原子、氮原子、氧原子和碳原子分别是1、2、2、6、3,而反应后的碳原子、氧原子、氮原子分别是3、6、2,故X为K2S;由于该反应的产物中还含有二氧化硫,所以还会发生S+O2 SO2的反应;
SO2的反应;
[测定步骤]:
(二)二氧化硫含量的测定
(3)依据实验叙述可知使用的气体量越小说明反应的越充分,也更接近准确,所以50最接近准确值,次数越多说明每次反应不充分;
[测定反思](1)采用多孔球泡能大大增加反应的接触面积使反应更充分,效果会更好一些;
(2)由于碘液的质量决定消耗的气体量,所以要想减少次数节约时间,就应该减小碘溶液的质量;
(3)根据燃放烟花爆竹爆炸噪音以及的产物中含有污染空气的二氧化硫气体、燃放后的固体废弃物和粉尘等污染物的存在,所以选项中A、B、C、D均是被选的答案;
故答案为:[实验过程]装置的气密性;紫红; 高锰酸钾;澄清石灰水;Ca(OH)2+CO2=CaCO3↓+H2O;
[实验反思](1)起到实验时对气体的缓冲作用;
(2)K2S;S+O2 SO2;
SO2;
[测定步骤]:
(二)二氧化硫含量的测定
(3)50;二氧化硫未能与溶液充分反应;
[测定反思](1)增加了反应物的接触面积,使反应更加充分;
(2)减少碘液的量;
(3)A、B、C、D;
点评:此题是一道实验探究题,属于起点高而落点低的基础性问题,只要能认真分析相关要求并结合相关的基础知识就能顺利解题;
[实验反思](1)根据该反应进行时较剧烈容易导致装置内气压偏大分析气球的作用;
(2)根据质量守恒定律的应用以及该反应的产物中还含有二氧化硫分析解答此题;
[测定步骤]:
(二)二氧化硫含量的测定
(3)根据次数越少说明反应越充分的原理判断那一次的反应更充分一些;
[测定反思](1)根据接触面积越大反应越充分分析多孔球泡的作用;
(2)根据碘液的质量决定消耗的气体量分析解答;
(3)根据燃放烟花爆竹的产物分析燃放烟花爆竹的危害;
解答:解:[实验过程]由于该装置需要气密性较好,所以首先对该装置要进行气密性检查的处理,由于二氧化硫具有漂白作用能使紫红色高锰酸钾溶液褪色,且二氧化硫、二氧化碳均能使石灰水变浑浊,所以应首先检验二氧化硫,而后利用二氧化碳能使石灰水变浑浊的特征检验二氧化碳;
[实验反思](1)由于该反应进行时较剧烈容易导致装置内气压偏大,所以放上气球可有效地对装置内的压强起到缓冲作用;
(2)根据质量守恒定律可知反应前后各原子的种类及个数不变,S+2KNO3+3C═3CO2+N2+X中反应前硫原子、钾原子、氮原子、氧原子和碳原子分别是1、2、2、6、3,而反应后的碳原子、氧原子、氮原子分别是3、6、2,故X为K2S;由于该反应的产物中还含有二氧化硫,所以还会发生S+O2
 SO2的反应;
SO2的反应;[测定步骤]:
(二)二氧化硫含量的测定
(3)依据实验叙述可知使用的气体量越小说明反应的越充分,也更接近准确,所以50最接近准确值,次数越多说明每次反应不充分;
[测定反思](1)采用多孔球泡能大大增加反应的接触面积使反应更充分,效果会更好一些;
(2)由于碘液的质量决定消耗的气体量,所以要想减少次数节约时间,就应该减小碘溶液的质量;
(3)根据燃放烟花爆竹爆炸噪音以及的产物中含有污染空气的二氧化硫气体、燃放后的固体废弃物和粉尘等污染物的存在,所以选项中A、B、C、D均是被选的答案;
故答案为:[实验过程]装置的气密性;紫红; 高锰酸钾;澄清石灰水;Ca(OH)2+CO2=CaCO3↓+H2O;
[实验反思](1)起到实验时对气体的缓冲作用;
(2)K2S;S+O2
 SO2;
SO2;[测定步骤]:
(二)二氧化硫含量的测定
(3)50;二氧化硫未能与溶液充分反应;
[测定反思](1)增加了反应物的接触面积,使反应更加充分;
(2)减少碘液的量;
(3)A、B、C、D;
点评:此题是一道实验探究题,属于起点高而落点低的基础性问题,只要能认真分析相关要求并结合相关的基础知识就能顺利解题;

练习册系列答案
相关题目