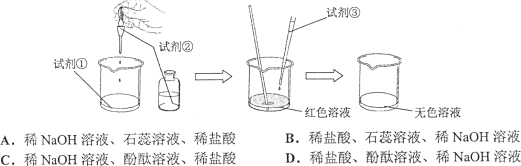
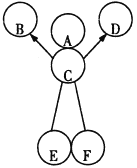
题目内容
【题目】(12分)甲、乙、丙、丁四种物质在一定条件下能发生如下反应:
甲+乙![]() 丙+丁
丙+丁
(1)若甲、丙为化合物,乙、丁为单质,则上述反应的基本反应类型是 ,写出一个符合该反应类型的方程式: 。
(2)若甲、乙、丙、丁均为化合物,且甲溶液呈蓝色,乙为烧碱,则乙的化学式为
,反应发生时观察到的现象是 。
(3)若甲、乙、丙、丁均为化合物,且丙为水,丁为盐,则该反应 (“一定”或“不一定”)是中和反应,理由是 。
(4)若甲、乙、丙为化合物,丁为单质,且乙、丙是组成元素相同的气体,该反应在工业上的用途是 。
【答案】(1)置换 C+ 2CuO 高温 2Cu + CO2↑ (2) NaOH 产生蓝色沉淀
(3) 不一定 中和反应是指酸碱发生反应,而甲、乙不一定是酸、碱
(4)冶炼金属
【解析】
试题分析:(1)置换反应概念:由一种单质与一种化合物反应,生成另一种单质与另一种化合物的反应,故若甲、丙为化合物,乙、丁为单质,则反应的基本反应类型是置换,符合该反应类型的方程式:C+ 2CuO 高温 2Cu + CO2↑或H2 + CuO △ Cu + H2O
(2)烧碱是氢氧化钠的俗名,化学式为NaOH,因为甲溶液呈蓝色,说明含铜离子,故反应发生时观察到的现象是:产生蓝色沉淀
(3)中和反应是指酸碱作用生成盐和水的反应,虽然生成物丙为水,丁为盐,但反应物并不能确定是酸碱,如反应:2NaOH + CO2 == Na2CO3 + H2O,生成盐和水,但不是复分解反应
(4)若甲、乙、丙为化合物,丁为单质,且乙、丙是组成元素相同的气体,则可推断乙应为CO,丙为CO2,体现了一氧化碳的还原性,在工业上的用途是冶炼金属

 综合自测系列答案
综合自测系列答案【题目】(7分)某同学做了如下图所示实验:
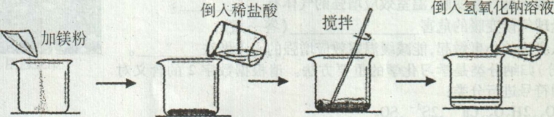
第一次 | 第二次 | |
加入镁粉的质量 | m | m |
加入质量分数为14.6%稀盐酸的质量 | 50g | lOOg |
加入氢氧化钠溶液的质量 | 100g | 100g |
加入氢氧化钠溶液后的实验现象 | 产生白色沉淀 | 无明显现象 |
第一次实验每步均恰好完全反应,请回答:
(1)写出第一次实验中发生反应的化学方程式___________________________;
(2)第二次反应后溶液中溶质的组成是___________________________;
(3)每次实验中加入镁的质量(m)为___________________________;
(4)求解第一次反应中生成气体的质量(X)的比例式为___________________________;
(5)若将第一次反应后溶液蒸发掉68.4g水后,则所得不饱和溶液中溶质的质量分数___________;
(6)若用36.5%的浓盐酸配制实验中所需稀盐酸,则需要加水的质量为_______________。