题目内容
【题目】某校化学兴趣小组参观制碱厂后,获得以下信息并对相关问题进行研究。(查阅资料)
①生产原料粗盐中含有少量可溶性杂质(MgSO4和CaC12)及不溶性杂质,生产过程中需先将粗盐精制。
②生产原理: ![]() 分离得晶体A,并使其充分受热,可分解制得纯碱及两种常见的氧化物。
分离得晶体A,并使其充分受热,可分解制得纯碱及两种常见的氧化物。
③氯化铵分解的化学方程式是: ![]()
④部分生产流程如图所示:
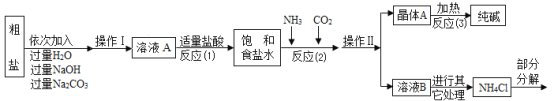
(问题讨论)
(1)①写出加入NaOH溶液所发生反应的化学方程式_______;
②操作I的名称是_________;
③反应(1)中加入适量盐酸的目的是_________;
(2)上述生产流程中可循环使用的物质是_______(填字母)。
A NH3
B NaOH
C HCl
D CO2
【答案】![]() 过滤 除去Na2CO3和NaOH ACD
过滤 除去Na2CO3和NaOH ACD
【解析】
(1)①粗盐中含有硫酸镁,加入氢氧化钠,氢氧化钠与硫酸镁反应生成氢氧化镁和硫酸钠,该反应的化学方程式为:![]() ;
;
②操作I可将难溶性物质除去得到溶液,故名称是过滤;
③向粗盐中加入过量水溶解,然后加入过量氢氧化钠,氢氧化钠与硫酸镁反应生成氢氧化镁和硫酸钠,加入过量碳酸钠,碳酸钠与氯化钙反应生成碳酸钙和氯化钠,加入适量稀盐酸,稀盐酸能与氢氧化钠反应生成氯化钠和水,碳酸钠能与稀盐酸反应生成氯化钠、二氧化碳和水,可除去过量的氢氧化钠和碳酸钠;
(2)![]() ,
,![]() ,碳酸氢钠加热分解为碳酸钠、二氧化碳和水,故二氧化碳、氯化氢、氨气既是反应物,又是生成物,可以循环利用。故选ACD。
,碳酸氢钠加热分解为碳酸钠、二氧化碳和水,故二氧化碳、氯化氢、氨气既是反应物,又是生成物,可以循环利用。故选ACD。

【题目】化学实验小组的同学们对催化剂产生了兴趣,通过查阅资料了解到氧化铁也能加速氯酸钾的分解。为了探究氧化铁能否加快过氧化氢的分解,他们设计了实验装置,并进行气体的制备和测量实验。实验时均以生成40mL气体为标准,相关实验数据记录如下表:
实验序号 | 过氧化氢溶液浓度/% | 过氧化氢溶液体积/mL | 过氧化氢溶液温度/℃ | 氧化铁的用量/g | 收集40mL氧气所需时间/s |
① | 5 | 10 | 20 | 0 | 128.5 |
② | 5 | 10 | 20 | 1.2 | 16.8 |
③ | 15 | 10 | 20 | 1.2 | 10.5 |
④ | 5 | 10 | 70 | 0 | 32.7 |
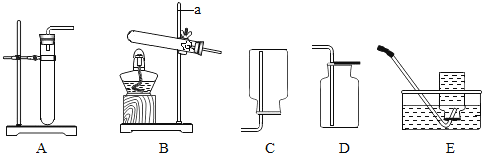
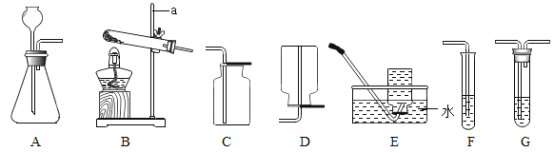
(1)完成上述实验及数据的测定需要用到下图中的部分装置,请按组装顺序写出所用到的装置代号____。
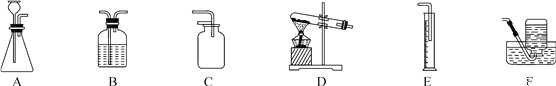
(2)通过实验①和④对比可知,化学反应速率与温度的关系是_______;通过实验②和③对比可知,化学反应速率与______有关;通过实验_______和______对比可知,氧化铁可以加快过氧化氢分解放氧的速率。
(3)若要证明氧化铁是过氧化氢分解的催化剂,还需要验证它在该反应前后的___和____未发生改变。
(4)同学们还想探究催化剂的颗粒大小对化学反应速率是否有影响,请你帮他们设计实验方案进行探究:_______。
【题目】在一密闭容器中,有X、O2、CO2、H2O四种物质,在一定条件下发生某种反应,反应一段时间后,测得反应前后各物质的质量如下表。下列说法正确的是( )
物质 | X | O2 | CO2 | H2O |
反应前的质量/g | 19 | 34 | 6 | 2 |
反应后的质量/g | 11 | 待测 | 28 | 20 |
A.表中的待测值为32
B.X 中可能含有氧元素
C.该反应是置换反应
D.该反应中CO2和H2O的化学计量数之比为1:2