题目内容
【题目】(7分)铁是最早使用的金属之一。
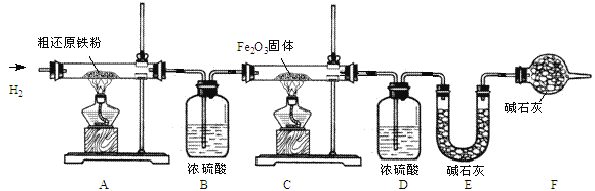
(1)下列铁制品,主要利用其导热性的是 (填字母序号)。

(2)工业上以赤铁矿(主要含氧化铁)为原料炼铁,反应的化学方程式为 。
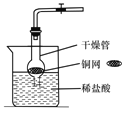
(3)铁粉是双吸剂的有效成分,原因是 。实际生产中用到的双吸剂除铁粉外,一般还含有NaCl和木炭粉。检验用过一段时间的双吸剂是否失效的方法是 。
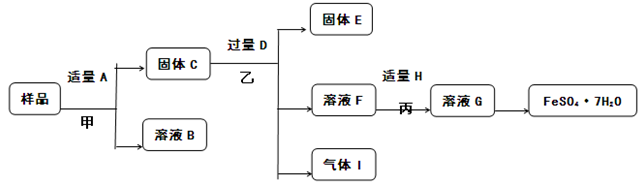
(5)已知“Fe”是植物生长必须的微量元素,FeSO4·7H2O常用作花肥。为保护环境,回收金属资源。课外小组的同学设计了如下图所示流程(略去部分产物),对用过一段时间的双吸剂进行回收。(说明:含“Fe3+”的盐溶液能与铁反应转化为“Fe2+”。如 Fe + 2FeCl3 ==== 3FeCl2,。)回答下列问题:
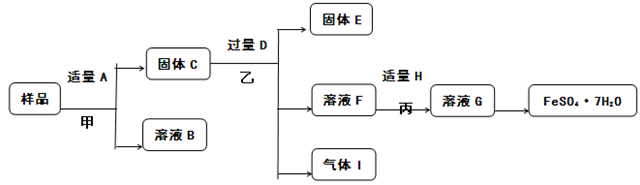
①上述流程中,共发生 个不同的化学反应。
②A-I九中物质中,含铁元素的是 (填字母序号)。
【答案】(1)B; (2)3CO + Fe2O3 高温 3CO2 + 2Fe ;(3)铁能吸收空气中的氧气和水蒸气; 取样,滴加稀盐酸,若有气泡产生说明没有完全失效;(4)①3 ; ②CFHG 。
【解析】
试题分析:(1)铲子主要利用铁的硬度大、熔点高的特点;铁锅主要利用铁的导热性;电炉丝主要利用铁的导电性;(2)工业上以赤铁矿(主要含氧化铁)为原料炼铁,主要是高温下利用一氧化碳还原氧化铁;反应的化学方程式为:3CO+Fe2O3△3CO2+2Fe;(3)铁粉成为双吸剂的有效成分,原因是铁能吸收空气中的氧气和水蒸气;检验用过一段时间的双吸剂是否失效主要就是检验双吸剂的有效成分是否存在,方法是:取样,滴加稀盐酸,若有气泡产生说明没有完全失效;(5)样品中可能含有氧化铁、铁、木炭粉、氯化钠等,用水A溶解,过滤得到固体C中可能含有氧化铁、铁、木炭粉等,加过量硫酸D,生成含有硫酸铁、硫酸亚铁的溶液F,向F中加适量铁粉H,得到含硫酸亚铁的溶液,蒸发结晶得到FeSO47H2O;所以:①上述流程中,共发生3个不同的化学反应.②A-I九中物质中,含铁元素的是CFHG.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案