题目内容
常见的食品脱氧剂多为无机铁系脱氧剂,其主要成分为活性铁粉.脱氧中的一步主要反应为:4Fe(OH)2+O2+2H2O=4Fe(OH)3 (红褐色固体)
(1)Fe(OH)2读作______;此反应的基本类型是______.
(2)某同学自制脱氧剂(2g铁粉、0.5g活性炭、0.5g食盐)进行如下两个实验:
实验Ⅰ:
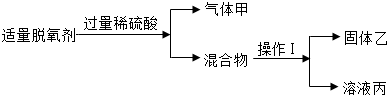
请回答:
乙在净水中用作______;溶液丙中含有的溶质是______(写化学式).
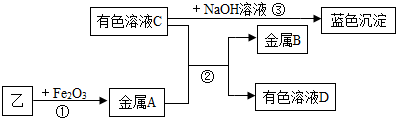
实验Ⅱ:将乙烘干后进行如下实验,物质之间的转化关系如下图(部分产物略去).

①金属B的化学式是______
②区别溶液C与溶液D物质的方法是______;
③反应③的化学方程式为:______.
解:(1)Fe(OH)2读作氢氧化亚铁,该反应由三种物质生成了一种物质属于化合反应.
实验Ⅰ:
由于固体乙的主要成分是活性炭,有吸附性,在净水中常用作吸附剂.由自制脱氧剂的成分可知,硫酸与铁反应生成了生成了硫酸亚铁.所以,溶液丙中含有的溶质是硫酸亚铁、剩余的硫酸,和原混合物中的氯化钠;
实验Ⅱ:
①由物质之间的转化关系可知,固体乙的主要成分是碳,在高温条件下与碳反应生成了铁;能与氢氧化钠反应生成蓝色沉淀的溶液应是硫酸铜溶液,所以,有色溶液C是硫酸铜,铁能与硫酸铜反应生成了铜和硫酸亚铁.故金属B是Cu,有色溶液D是硫酸亚铁;
②由上述分析可知,溶液C、D分别是硫酸铜和硫酸亚铁,由于颜色的不同.区别溶液C与溶液D物质的方法是观察溶液颜色,浅绿色为FeSO4溶液,蓝色为CuSO4溶液;
③由上述分析可知,反应③是硫酸铜与氢氧化钠反应生成了氢氧化铜沉淀和硫酸钠,反应的方程式是:CuSO4+2NaOH=Cu(OH)2↓+Na2SO4..
故答为:(1)氢氧化亚铁,化合反应;(2)实验Ⅰ:吸附剂; FeSO4、NaCl、H2SO4;
实验Ⅱ:①Cu;②观察溶液颜色,浅绿色为FeSO4溶液,蓝色为CuSO4溶液;③CuSO4+2NaOH=Cu(OH)2↓+Na2SO4.
分析:(1)根据碱的命名方法读出名称,根据反应的特点分析反应的类型;
实验Ⅰ:
根据活性炭的吸附性分析在净水中作用,根据自制脱氧剂的成分的性质分析溶液丙中含有的溶质;
实验Ⅱ:
①根据物质之间的转化关系可知,固体乙的主要成分是碳,在高温条件下与碳反应生成了铁;能与氢氧化钠反应生成蓝色沉淀的溶液应是硫酸铜溶液,铁能与硫酸铜反应生成了铜和硫酸亚铁.由此可推出各物质,分析回答有关的问题;
②根据溶液的颜色不同区别溶液C、D;
③根据反应写出反应的方程式.
点评:本题主要考查实验探究方面的知识,解答时要依据物质的性质分析反应流程图,明确具体的物质性质来解决相关问题.
实验Ⅰ:
由于固体乙的主要成分是活性炭,有吸附性,在净水中常用作吸附剂.由自制脱氧剂的成分可知,硫酸与铁反应生成了生成了硫酸亚铁.所以,溶液丙中含有的溶质是硫酸亚铁、剩余的硫酸,和原混合物中的氯化钠;
实验Ⅱ:
①由物质之间的转化关系可知,固体乙的主要成分是碳,在高温条件下与碳反应生成了铁;能与氢氧化钠反应生成蓝色沉淀的溶液应是硫酸铜溶液,所以,有色溶液C是硫酸铜,铁能与硫酸铜反应生成了铜和硫酸亚铁.故金属B是Cu,有色溶液D是硫酸亚铁;
②由上述分析可知,溶液C、D分别是硫酸铜和硫酸亚铁,由于颜色的不同.区别溶液C与溶液D物质的方法是观察溶液颜色,浅绿色为FeSO4溶液,蓝色为CuSO4溶液;
③由上述分析可知,反应③是硫酸铜与氢氧化钠反应生成了氢氧化铜沉淀和硫酸钠,反应的方程式是:CuSO4+2NaOH=Cu(OH)2↓+Na2SO4..
故答为:(1)氢氧化亚铁,化合反应;(2)实验Ⅰ:吸附剂; FeSO4、NaCl、H2SO4;
实验Ⅱ:①Cu;②观察溶液颜色,浅绿色为FeSO4溶液,蓝色为CuSO4溶液;③CuSO4+2NaOH=Cu(OH)2↓+Na2SO4.
分析:(1)根据碱的命名方法读出名称,根据反应的特点分析反应的类型;
实验Ⅰ:
根据活性炭的吸附性分析在净水中作用,根据自制脱氧剂的成分的性质分析溶液丙中含有的溶质;
实验Ⅱ:
①根据物质之间的转化关系可知,固体乙的主要成分是碳,在高温条件下与碳反应生成了铁;能与氢氧化钠反应生成蓝色沉淀的溶液应是硫酸铜溶液,铁能与硫酸铜反应生成了铜和硫酸亚铁.由此可推出各物质,分析回答有关的问题;
②根据溶液的颜色不同区别溶液C、D;
③根据反应写出反应的方程式.
点评:本题主要考查实验探究方面的知识,解答时要依据物质的性质分析反应流程图,明确具体的物质性质来解决相关问题.

练习册系列答案
相关题目

 (2012?通州区二模)人类生活离不开金属.
(2012?通州区二模)人类生活离不开金属.