题目内容
研究氢气、一氧化碳和二氧化碳具有重要意义。
(1)实验室用锌和稀硫酸制取氢气的化学方程式是___________________________________。研究发现:利用硫—碘循环分解水制取氢气,主要涉及下列反应(反应条件已略):
Ⅰ.SO2+2H2O+I2=H2SO4+2HI Ⅱ.2HI=H2+I2 Ⅲ.2H2SO4=2SO2+O2+2H2O
请回答:反应Ⅲ属于______________反应(填基本反应类型);循环分解水的过程产生O2和H2的质量比为______________。
(2)在汽车“催化转化器”内发生的反应的化学方程式是2NO+2CO N2+2CO2,某化学探究小组的同学为探究温度,催化剂的比面积对化学反应速率的影响,设计了下列三组实验。
N2+2CO2,某化学探究小组的同学为探究温度,催化剂的比面积对化学反应速率的影响,设计了下列三组实验。
分析上表中实验数据,回答下列问题:探究温度对化学反应速率影响的实验是____________(填写实验编号);探究催化剂的比表面积对化学反应速率影响的实验是_____________(填写实验编号)。
(3)在300℃、70MPa下,使用催化剂可由氢气和二氧化碳合成乙醇,同时生成水。写出反应的化学方程式_________________________________________________________________。
(4)燃料燃烧时产生的热量不同,已知在某温度下各种燃料燃烧时产生的热量见下表:
分析表中数据,燃料单位质量的上述燃料产生的顺序是___________________________________(用化学式表示)。
(1)实验室用锌和稀硫酸制取氢气的化学方程式是___________________________________。研究发现:利用硫—碘循环分解水制取氢气,主要涉及下列反应(反应条件已略):
Ⅰ.SO2+2H2O+I2=H2SO4+2HI Ⅱ.2HI=H2+I2 Ⅲ.2H2SO4=2SO2+O2+2H2O
请回答:反应Ⅲ属于______________反应(填基本反应类型);循环分解水的过程产生O2和H2的质量比为______________。
(2)在汽车“催化转化器”内发生的反应的化学方程式是2NO+2CO
 N2+2CO2,某化学探究小组的同学为探究温度,催化剂的比面积对化学反应速率的影响,设计了下列三组实验。
N2+2CO2,某化学探究小组的同学为探究温度,催化剂的比面积对化学反应速率的影响,设计了下列三组实验。| 实验编号 | T/℃ | NO初始浓度/g·l-1 | CO初始浓度/g·l-1 | 催化剂的比表面积/m2·g-1 |
| Ⅰ | 280 | 0.036 | 0.162 | 82 |
| Ⅱ | 280 | 0.036 | 0.162 | 124 |
| Ⅲ | 350 | 0.036 | 0.162 | 124 |
分析上表中实验数据,回答下列问题:探究温度对化学反应速率影响的实验是____________(填写实验编号);探究催化剂的比表面积对化学反应速率影响的实验是_____________(填写实验编号)。
(3)在300℃、70MPa下,使用催化剂可由氢气和二氧化碳合成乙醇,同时生成水。写出反应的化学方程式_________________________________________________________________。
(4)燃料燃烧时产生的热量不同,已知在某温度下各种燃料燃烧时产生的热量见下表:
| 燃料 | 质量/g | 产物 | 产生的热量/KJ |
| 氢气 | 2 | 水蒸气 | 241.8 |
| 甲烷 | 16 | 二氧化碳气体和水蒸气 | 890.3 |
| 乙醇 | 46 | 二氧化碳气体和水蒸气 | 1367 |
分析表中数据,燃料单位质量的上述燃料产生的顺序是___________________________________(用化学式表示)。
(1)Zn+H2SO4=ZnSO4+H2↑(1分) 分解(1分) 8:1(2分)
(2)Ⅱ和Ⅲ(1分) Ⅰ和Ⅱ(1分)
(3)6H2+2CO2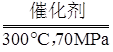 C2H5OH+3H2O(2分)
C2H5OH+3H2O(2分)
(4)H2、CH4、C2H5OH(2分)
(2)Ⅱ和Ⅲ(1分) Ⅰ和Ⅱ(1分)
(3)6H2+2CO2
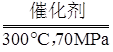 C2H5OH+3H2O(2分)
C2H5OH+3H2O(2分)(4)H2、CH4、C2H5OH(2分)
(1)考查化学方程式的书写、计算与反应类型的判断,难度不大。锌和稀硫酸制取氢气的化学方程式是Zn+H2SO4=ZnSO4+H2↑;2H2SO4=2SO2+O2+2H2O是由一种物质生成三种物质,属于分解反应。水分解的化学方程式为2H2O 2H2↑+ O2↑,氧气与氢气的质量比为32:2×2=8:1;(2)探究影响反应速率的因素,注意实验的相同条件和不同条件,不同条件只能有一个。探究温度对化学反应的影响的实验是Ⅱ和Ⅲ,探究催化剂的比表面积对化学反应速率影响的实验是Ⅰ和Ⅱ;(3)根据题目提供的信息书写化学方程式,解题的关键是化学方程式的配平。6H2+2CO2
2H2↑+ O2↑,氧气与氢气的质量比为32:2×2=8:1;(2)探究影响反应速率的因素,注意实验的相同条件和不同条件,不同条件只能有一个。探究温度对化学反应的影响的实验是Ⅱ和Ⅲ,探究催化剂的比表面积对化学反应速率影响的实验是Ⅰ和Ⅱ;(3)根据题目提供的信息书写化学方程式,解题的关键是化学方程式的配平。6H2+2CO2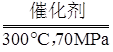 C2H5OH+3H2O;(4)燃烧单位质量的上述燃料产生的热量分别是氢气:241.8÷2=120.9kJ,甲烷:890.3÷16=55.64kJ,乙醇:1367÷46=29.72kJ。
C2H5OH+3H2O;(4)燃烧单位质量的上述燃料产生的热量分别是氢气:241.8÷2=120.9kJ,甲烷:890.3÷16=55.64kJ,乙醇:1367÷46=29.72kJ。
 2H2↑+ O2↑,氧气与氢气的质量比为32:2×2=8:1;(2)探究影响反应速率的因素,注意实验的相同条件和不同条件,不同条件只能有一个。探究温度对化学反应的影响的实验是Ⅱ和Ⅲ,探究催化剂的比表面积对化学反应速率影响的实验是Ⅰ和Ⅱ;(3)根据题目提供的信息书写化学方程式,解题的关键是化学方程式的配平。6H2+2CO2
2H2↑+ O2↑,氧气与氢气的质量比为32:2×2=8:1;(2)探究影响反应速率的因素,注意实验的相同条件和不同条件,不同条件只能有一个。探究温度对化学反应的影响的实验是Ⅱ和Ⅲ,探究催化剂的比表面积对化学反应速率影响的实验是Ⅰ和Ⅱ;(3)根据题目提供的信息书写化学方程式,解题的关键是化学方程式的配平。6H2+2CO2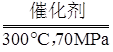 C2H5OH+3H2O;(4)燃烧单位质量的上述燃料产生的热量分别是氢气:241.8÷2=120.9kJ,甲烷:890.3÷16=55.64kJ,乙醇:1367÷46=29.72kJ。
C2H5OH+3H2O;(4)燃烧单位质量的上述燃料产生的热量分别是氢气:241.8÷2=120.9kJ,甲烷:890.3÷16=55.64kJ,乙醇:1367÷46=29.72kJ。
练习册系列答案
 步步高达标卷系列答案
步步高达标卷系列答案
相关题目

