题目内容
【题目】某校化学兴趣小组对苏打(Na2CO3)和小苏打(NaHCO3)在生活中具有何作用,如何鉴别苏打和小苏打进行了如下的探究实验活动,请你参与他们的探究过程,并回答相关问题:
【查阅资料】信息①:相同条件下,碳酸钠溶液比碳酸氢钠溶液碱性强;信息②:NaHCO3在270℃时,完全分解转化成Na2CO3,而Na2CO3不易分解。
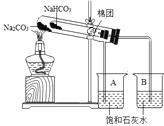
【实验过程】(1)按下图所示进行实验,只观察到烧杯B中的石灰水变浑浊,小试管内壁出现水珠,写出小苏打分解的化学方程式:_________________________。
(2)充分利用信息知识,区分溶质质量分数相同的无色Na2CO3溶液与NaHCO3溶液最简单的方法是________。
A.加热 B.pH试纸 C.稀盐酸
(3)可用小苏打治疗轻度胃酸(主要含盐酸)过多的病人,其原因是________________。
【答案】 2NaHCO3![]() Na2CO3+H2O+CO2↑ B NaHCO3+HCl=NaCl+H2O+CO2 ↑ (或者:碳酸氢钠碱性较弱,服用以后不会对人体造成伤害,并且可以与胃酸反应,消耗部分胃酸,从而起到治疗胃酸过多的作用)
Na2CO3+H2O+CO2↑ B NaHCO3+HCl=NaCl+H2O+CO2 ↑ (或者:碳酸氢钠碱性较弱,服用以后不会对人体造成伤害,并且可以与胃酸反应,消耗部分胃酸,从而起到治疗胃酸过多的作用)
【解析】(1)加热碳酸氢钠,观察到烧杯B中的石灰石变浑浊,小试管内壁出现水珠,说明碳酸氢钠分解产生二氧化碳和水,且根据信息②可知还生成碳酸钠,故反应的方程式为:2NaHCO3![]() Na2CO3+H2O+CO2↑;
Na2CO3+H2O+CO2↑;
(2)A.信息②:NaHCO3在270℃时,完全分解转化成Na2CO3,而NaHCO3不易分解,此法可行,但操作比较麻烦,故A不正确;B.信息①:相同条件下,碳酸钠溶液比碳酸氢钠溶液碱性强,因此可以测定两种溶液的pH,pH大的是碳酸钠溶液,方法较简单,故B正确;C.稀盐酸和碳酸钠、碳酸氢钠都能反应产生二氧化碳,现象相同,不能鉴别,故C错误;故答案为B;
(3)因为碳酸氢钠碱性较弱,服用以后不会对人体造成伤害,并且可以与胃酸反应,消耗部分胃酸,发生的反应为NaHCO3+HCl═NaCl+H2O+CO2↑,从而起到治疗胃酸过多的作用。

 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案