题目内容
某工厂利用废铁屑与一定质量分数废硫酸反应制取硫酸亚铁.现有1.2t废铁屑与一定质量分数9.8t废硫酸恰好完全反应(假设废铁屑中除铁以外的物质不溶于水且不与稀硫酸反应),反应后所得物质总质量为10.98t.我能完成下列计算:(1)废铁屑中铁的质量.
(2)当废铁屑恰好完全反应时所得溶液中溶质的质量分数.(结果保留一位小数)
【答案】分析:(1)本题中所发生的反应为铁和硫酸的反应,根据反应前后物质质量变化可以求算出生成的氢气的质量,进而结合化学方程式来求算出铁的质量;
(2)根据化学方程式可以知道铁屑和废硫酸恰好完全反应时,所得溶液为硫酸亚铁溶液,可以据此来求算出反应后溶液中溶质的质量分数.
解答:解:(1)根据质量守恒定律可以知道生成的氢气的质量为:9.8t+1.2t-10.98t=0.02t
设废铁屑中铁的质量为x,生成了硫酸亚铁的质量为y,
Fe+H2SO4=FeSO4+H2↑
56 152 2
x y 0.02t
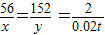
解得:x=0.56t,y=1.52t;
(2)所以反应后所得溶液中溶质的质量分数为: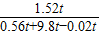 ×100%=14.7%.
×100%=14.7%.
答:1)废铁屑中铁的质量为0.56t.
(2)当废铁屑恰好完全反应时所得溶液中溶质的质量分数为14.7%.
点评:解答这类题目的关键是根据质量守恒定律判断出氢气的质量,并求算反应后所得溶液质量的计算方法:恰好完全反应后所得溶液的质量=参加反应铁的质量+所加稀硫酸的质量-反应放出氢气的质量.
(2)根据化学方程式可以知道铁屑和废硫酸恰好完全反应时,所得溶液为硫酸亚铁溶液,可以据此来求算出反应后溶液中溶质的质量分数.
解答:解:(1)根据质量守恒定律可以知道生成的氢气的质量为:9.8t+1.2t-10.98t=0.02t
设废铁屑中铁的质量为x,生成了硫酸亚铁的质量为y,
Fe+H2SO4=FeSO4+H2↑
56 152 2
x y 0.02t
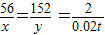
解得:x=0.56t,y=1.52t;
(2)所以反应后所得溶液中溶质的质量分数为:
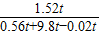 ×100%=14.7%.
×100%=14.7%.答:1)废铁屑中铁的质量为0.56t.
(2)当废铁屑恰好完全反应时所得溶液中溶质的质量分数为14.7%.
点评:解答这类题目的关键是根据质量守恒定律判断出氢气的质量,并求算反应后所得溶液质量的计算方法:恰好完全反应后所得溶液的质量=参加反应铁的质量+所加稀硫酸的质量-反应放出氢气的质量.

练习册系列答案
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案
相关题目