��Ŀ����
����Ŀ��ͬѧ�Ƕ�������㳣�����ɼ�Na2CO3��NaHCO3����������̽����
���������ϡ�
��̽��һ��NaHCO3��Na2CO3���ʲ����̽��
��1������20��ʱ������������Ϊ8%��Na2CO3��NaHCO3��Һ
����ԣ�ȡ�����Թ��У��ֱ�μ���ɫʯ����Һ������ɫ��
���ȣ�NaHCO3��Һ Na2CO3��Һ(�����������)��
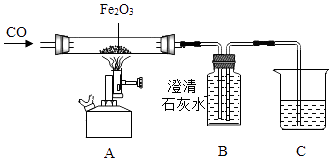
��2���ȶ��ԣ�����ͼ��ʵ���пɹ۲����ձ��е�ʯ��ˮ����ǣ����ձ����䣬�����ձ���Ӧ���Թ��з�����Ӧ�Ļ�ѧ����ʽΪ����
���ۣ������������£�̼���Ʊ�̼�������ȶ������ǿ������������
��3�������ܽ�ȼ���NaHCO3��Na2CO3���ֱ�ȡXg���ֹ����ĩ����20�棬10gˮ�г���ܽ⣬ͨ���۲��ܽ����������֣�X���������е� ��ѡ��A��B��C��
A.1.5g
B.0.96g
C.0.5g
��4�����������ۡ� ʵ�����ʱ��Ӧ�� ��ѡ��A��B��
A.Ϩ��ƾ���
B.�Ѽס����ձ��ƿ�
��5��С�Թ�������������
��6����̽�������ⶨNaHCO3��Na2CO3�����10.0g��NaHCO3��������������ͼ���г�װ���ԣ�
���������ۡ�
ʵ��ǰ��ͨһ��ʱ��Ŀ�����Ŀ������
��7��A�������� �� ��û��װ��E��NaHCO3�����������ⶨ��������ƫ�������䡱��ƫС������
��8��ֹͣ���Ⱥ��Լ���ͨ�����һ��ʱ�䣬Ŀ������
��9���������ⶨ��
���װ��D������ʵ��ǰΪ120.2g��ʵ���Ϊ122.4g���������Ʒ��NaHCO3��������������Ҫ�м�����̣�
��10����֪ʶ��չ��
��Na2CO3��Һ��ͨ��CO2�����������NaHCO3 �� �÷�Ӧ�Ļ�ѧ��Ӧ����ʽΪ����
���𰸡�
��1����ɫ,<
��2��2NaHCO3 ![]() Na2CO3 + H2O + CO2��,ǿ
Na2CO3 + H2O + CO2��,ǿ
��3��A
��4��B
��5����ֹҩƷ����������
��6���ž�װ���ڵĿ������������̼��
��7�����չ�������еĶ�����̼,ƫ��
��8��ʹ��Ӧ���ɵĶ�����̼ȫ����D���ս�
��9��84%
��10��Na2CO3+CO2+H2O=2NaHCO3
����������1��������ҺpHֵ��֪��Na2CO3��Һ��NaHCO3��Һ�Լ��ԣ��μ���ɫʯ����Һ������ɫ����Һ�ļ���Խǿ��pHԽ��NaHCO3��Һ��Na2CO3��Һ��
��2��̼�����Ƽ��ȷֽ�Ϊ̼���ơ�ˮ�Ͷ�����̼���Թ��з�����Ӧ�Ļ�ѧ����ʽΪ��2NaHCO3��Na2CO3+H2O+CO2���������������£�̼���Ʊ�̼�������ȶ���ǿ��
��3��20��ʱ̼���ƺ�̼�����Ƶ��ܽ�ȷֱ�Ϊ21.5g��9.6g����ô�ڸ��¶��£�10gˮ������ܽ�2.15g̼���ƴﵽ���ͣ�����ܽ�0.96g̼�����ƴﵽ���ͣ���˿ɷֱ����2g���壬��ֽ��������ȫ�ܽ���Ϊ̼���ƣ���������ȫ�ܽ���Ϊ̼�����ƣ�
��4��ʵ�����ʱ��Ϊ��ֹ�ձ��е�ˮ�������Թܣ����Թ�ը�ѣ�Ӧ�Ƚ��ס����ձ��ƿ���
��5���������ã���ֹҩƷ���������ܣ�
��6��ʵ��ǰ��ͨһ��ʱ��Ŀ�����Ŀ�����ž�װ���ڵĿ������������̼����
��7��������װ��Aʱ�����еĶ�����̼���������Ʒ�Ӧ����̼���ƺ�ˮ����û�д�װ�ã���װ��D����ƫ����Ϊ���ɵĶ�����̼����ƫ��A�����������չ�������еĶ�����̼����ɲⶨ���ƫ��
��8��ֹͣ���Ⱥ��Լ���ͨ�����һ��ʱ�䣬Ŀ����ʹ��Ӧ���ɵĶ�����̼ȫ����D���գ�
��9����10.0g��Ʒ�к�̼�����Ƶ�����x
2NaHCO3![]() Na2CO3+H2O+CO2����
Na2CO3+H2O+CO2����
168 44
x 124.4g-122.2g
![]() =
=![]()
x=8.4g
����Ʒ��̼�����Ƶ���������Ϊ ![]() ��100%=84%��10����Na2CO3��Һ��ͨ��CO2�����������NaHCO3���÷�Ӧ�Ļ�ѧ��Ӧ����ʽΪ��Na2CO3+CO2+H2O�T2NaHCO3.
��100%=84%��10����Na2CO3��Һ��ͨ��CO2�����������NaHCO3���÷�Ӧ�Ļ�ѧ��Ӧ����ʽΪ��Na2CO3+CO2+H2O�T2NaHCO3.
�ʴ�Ϊ����1����ɫ��������2��2NaHCO3![]() Na2CO3+H2O+CO2����ǿ����3��A����4��B����5����ֹҩƷ���������ܣ���6���ž�װ���ڵĿ������������̼������7�����չ�������еĶ�����̼��ƫ��8��ʹ��Ӧ���ɵĶ�����̼ȫ����D���ս⣻��9��84%����10��Na2CO3+CO2+H2O=2NaHCO3.
Na2CO3+H2O+CO2����ǿ����3��A����4��B����5����ֹҩƷ���������ܣ���6���ž�װ���ڵĿ������������̼������7�����չ�������еĶ�����̼��ƫ��8��ʹ��Ӧ���ɵĶ�����̼ȫ����D���ս⣻��9��84%����10��Na2CO3+CO2+H2O=2NaHCO3.
��1��������ҺpHֵ��������Խ�𣻾ݲⶨ��Һ���ȵķ����Լ���Һ������������ԵĹ�ϵ��������
��2������̼�����Ƽ��ȷֽ�Ϊ̼���ơ�ˮ�Ͷ�����̼��������
��3������20��ʱ̼���ƺ�̼�����Ƶ��ܽ����������
��4������ʵ�����ʱ��Ϊ��ֹ�ձ��е�ˮ�������Թܣ����Թ�ը�ѣ�Ӧ�Ƚ��ס����ձ��ƿ����
��5�������������÷�����
��6������ʵ��ǰ��ͨһ��ʱ��Ŀ�����Ŀ�����ž�װ���ڵĿ������������̼�����
��7�����ݿ�������װ��Aʱ�����еĶ�����̼���������Ʒ�Ӧ����̼���ƺ�ˮ����û�д�װ�ã���װ��D����ƫ����Ϊ���ɵĶ�����̼����ƫ���𣻣�8������ֹͣ���Ⱥ��Լ���ͨ�����һ��ʱ�䣬Ŀ����ʹ��Ӧ���ɵĶ�����̼ȫ����D���ս��
��9�����ݷ�Ӧǰ�������ٵ�����Ϊ���ɵĶ�����̼�����������÷�Ӧ�Ļ�ѧ���̼�����
��10�����ݷ�Ӧԭ��д����Ӧ�Ļ�ѧ����ʽ���

����Ŀ��ijͬѧΪ�˲ⶨͭþ�Ͻ���Ʒ��ͭ��������������100gϡ�����2�μ��뵽ʢ��5g����Ʒ���ձ��У��������������������˵���д�����ǣ� ��
���� | ʵ��ǰ | ��1�� | ��2�� |
����ϡ���������/g | 0 | 50 | 50 |
ʣ����������/g | 5 | 3 | 2 |
A.��1�μ���ϡ�����ʣ������л���þ
B.��2���������ϡ����δ��Ӧ��
C.ÿ50gϡ�����1gþǡ����ȫ��Ӧ
D.�Ͻ���Ʒ��ͭ����������Ϊ40%