题目内容
将7g高锰酸钾放入大试管中加热一段时间,试管冷却后,称得剩余固体质量为6.36g.计算制得氧气多少克?6.36g固体物质中含有哪些物质?各多少克?
解:反应放出氧气的质量=7g-6.36g=0.64g
设分解高锰酸钾的质量为x,生成锰酸钾的质量为y,生成二氧化锰的质量为z
2KMnO4 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
316 197 87 32
x y z 0.64g
 =
=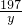 =
= =
=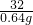
x=6.32g,y=3.94g,z=1.74g
则固体物质中含高锰酸钾的质量=7g-6.32g=0.68g
答:制得氧气0.64g;固体物质中含有0.68g高锰酸钾、3.94g锰酸钾、1.74g二氧化锰.
分析:根据高锰酸钾受热分解生成锰酸钾、二氧化锰和氧气,可知由于氧气的放出而使加热一段时间后试管内固体质量减少,因此利用质量守恒定律,首先计算放出氧气的质量,然后利用反应中各物质的质量关系逐一计算消耗高锰酸钾的质量、生成锰酸钾的质量和生成生成二氧化锰的质量,从而对剩余固体做出判断.
点评:首先利用质量守恒定律求得放出氧气质量,然后根据反应的化学方程式可以表示反应中各物质的质量比,由反应放出氧气的质量可计算出反应中其它物质的质量.
设分解高锰酸钾的质量为x,生成锰酸钾的质量为y,生成二氧化锰的质量为z
2KMnO4
 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑316 197 87 32
x y z 0.64g
 =
=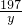 =
= =
=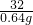
x=6.32g,y=3.94g,z=1.74g
则固体物质中含高锰酸钾的质量=7g-6.32g=0.68g
答:制得氧气0.64g;固体物质中含有0.68g高锰酸钾、3.94g锰酸钾、1.74g二氧化锰.
分析:根据高锰酸钾受热分解生成锰酸钾、二氧化锰和氧气,可知由于氧气的放出而使加热一段时间后试管内固体质量减少,因此利用质量守恒定律,首先计算放出氧气的质量,然后利用反应中各物质的质量关系逐一计算消耗高锰酸钾的质量、生成锰酸钾的质量和生成生成二氧化锰的质量,从而对剩余固体做出判断.
点评:首先利用质量守恒定律求得放出氧气质量,然后根据反应的化学方程式可以表示反应中各物质的质量比,由反应放出氧气的质量可计算出反应中其它物质的质量.

练习册系列答案
相关题目