题目内容
【题目】某同学利用如图装置进行了实验探究. 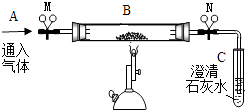
(1)【认识仪器】装置中的热源是 .
(2)【实验探究一】探究燃烧的条件,B处盛放木炭,松开弹簧夹M和N.步骤如下:
①先在A处通入氮气一段时间后,在B处加热,B、C处没有明显变化;
②待B处冷却至室温,在A处通入氧气一段时间后,B、C处没有明显变化;
③在A处继续通入氧气,然后在B处加热,发现木炭燃烧,C处变浑浊.
则:①与③对比,说明燃烧的条件之一是;
②与③对比,说明燃烧的条件之一是 .
(3)【实验探究二】探究铁与氧化铁化合的生成物的成分.
查阅资料:FeO不能被磁铁吸引;Fe3O4能被磁铁吸引.
提出猜想:猜想①是FeO; 猜想②是Fe3O4; 猜想③是的混合物.
猜想产物是FeO或Fe3O4的理由是 A:B:
实验步骤:(完成相关空格内容)
①连接组装仪器, .
②称取16.0g氧化铁粉末与一定量铁粉,将其迅速均匀混合后,再放入玻璃管底部并薄薄地平摊开来.
③松开弹簧夹M和N,通入CO2 , 当观察到现象X时,夹上弹簧夹M,开始加热玻璃管.
④当混合固体全部呈黑色后, , 停止加热待玻璃管冷却至室温.将玻璃管中黑色粉末倒在滤纸上,观察到黑色粉末未变色,用磁铁吸引,能被磁铁完全吸引.
实验结论:猜想成立.
实验拓展:上述探究实验中使用CO2 的目的是 , 判断该目的达成的现象X是 , (“能”或“不能”)用CO代替CO2进行上述探究实验.若黑色固体不能被磁铁全部吸引,且滴加稀盐酸,无气泡产生.则所加铁粉的质量范围是 .
【答案】
(1)酒精喷灯
(2)与氧气接触;温度达到着火点
(3)FeO和Fe3O4;反应后元素的种类不变;FeO或Fe3O4中铁元素的质量分数高于氧化铁;检查装置的气密性,夹上弹簧夹;继续通入CO2;②;作保护气,防止铁粉被氧化;澄清的石灰水变浑浊;不能;1.4g~5.6g
【解析】解:(1)根据实验室常用仪器的名称,装置中的热源是:酒精喷灯;(2)①与③对比,通入的气体不同,温度相同,所以说明燃烧的条件之一是:与氧气接触;②与③对比,通入的气体相同,温度不同,所以说明燃烧的条件之一是:温度达到着火点;(3)提出猜想:根据质量守恒定律猜想铁与氧化铁化合的生成物的成分应为FeO或Fe3O4或FeO和Fe3O4的混合物;猜想产物是FeO或Fe3O4的理由是:反应后元素的种类变,FeO或Fe3O4中铁元素的质量分数高于氧化铁,故应填写:FeO和Fe3O4;反应后元素的种类变;FeO或Fe3O4中铁元素的质量分数高于氧化铁;
实验步骤:(完成相关空格内容)①连接组装仪器之后,首先检查装置的气密性,夹上弹簧夹为开始实验做好准备;④实验结束前,为防止灼热的生成物与空气接触发生反应,应继续通入原来的气体,直到生成物冷却为止,故填写:检查装置的气密性,夹上弹簧夹;继续通入CO2;
实验结论:生成的黑色粉末能被磁铁完全吸引,说明铁与氧化铁化合的生成物的成分为Fe3O4 , 故填写:②;
实验拓展:(4)上述探究实验中使用CO2 可以起到排除空气,作保护气,防止铁粉被氧化的作用;该操作达成的现象X是试管中的澄清的石灰水变浑浊;因为加热条件下CO能与氧化铁发生反应,所以不能用CO代替CO2进行上述探究实验,故填写:作保护气,防止铁粉被氧化;澄清的石灰水变浑浊;不能;(5)假设产物只有氧化亚铁,需要的铁的质量为x.
Fe2O3+ | Fe |
| 3FeO |
160 | 56 | ||
16.0g | x |
![]()
x=5.6g
假设产物只有四氧化三铁,需要的铁的质量为y.
4Fe2O3+ | Fe |
| 3Fe3O4 |
640 | 56 | ||
16.0g | y |
![]()
y=1.4g
若黑色固体不能被磁铁全部吸引,且滴加稀盐酸,无气泡产生,说明剩余固体中含有氧化亚铁,并且没有铁单质;所以所加铁粉的质量范围是1.4g~5.6g.
故填:1.4g~5.6g.
【考点精析】利用金属材料的选择依据和书写化学方程式、文字表达式、电离方程式对题目进行判断即可得到答案,需要熟知黑色金属:通常指铁、锰、铬及它们的合金.重金属:如铜、锌、铅等;有色金属轻金属:如钠、镁、铝等;有色金属:通常是指除黑色金属以外的其他金属;注意:a、配平 b、条件 c、箭号.

【题目】铜镁合金常用作飞机天线等导电材料.化学兴趣小组要测定某种铜镁合金的组成(其他元素忽略不计),进行如下实验:取铜镁合金10g放入烧杯,将150g稀硫酸分3次加入,充分反应后,测得剩余固体的质量如下:
次 数 | 1 | 2 | 3 |
加入稀硫酸质量/g | 50 | 50 | 50 |
剩余固体质 量/g | 8.8 | 7.6 | 6.6 |
(1)10g铜镁合金中铜的质量是g.
(2)求稀硫酸中溶质的质量分数(结果精确到0.1%).