题目内容
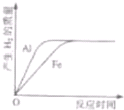 将质量相等的铝粉和铁粉分别与同体积、同质量分数稀硫酸反应.反应情况如图所示.有关叙述中可能正确的是( )
将质量相等的铝粉和铁粉分别与同体积、同质量分数稀硫酸反应.反应情况如图所示.有关叙述中可能正确的是( )分析:根据等质量金属完全反应放出氢气质量大小关系:Al>Fe,若质量相等的铝、铁都完全反应,铝与酸反应放出氢气的量一定大于铁与酸的反应;由图可以看出,最后铝和铁生成的氢气质量相同,故置换出的氢的质量相等,说明硫酸全部参加反应,根据同质量的铝铁生成的氢气量是铝大于铁,然后根据反应的化学方程式,根据铝和铁与硫酸反应的质量关系,判断消耗铝和铁的质量情况.
解答:解:A、由图示分析可知铝产生氢气的斜率比铁大,故铝的活动性比铁的强;铝的相对原子质量是27,铁的是56,故A错误;
B、利用方程式的计算求出消耗相同硫酸时需要铝铁的质量大小关系:
设19.6g的硫酸(100g,其溶质质量分数为19.6%)完全反应需要铝的质量为x,铁的质量为y
2Al+3H2SO4=Al2(SO4)3+3H2↑
54 294
x 19.6g
=
x=1.8g
Fe+H2SO4=FeSO4+H2↑
56 98
y 19.6g
=
y=11.2g
由此可以看出,产生等质量的氢气需要铁的质量大,而铁只有5.6g,铝剩余,故B错误;
C、由图示分析可知两者最终生成的氢气质量相等,所以消耗的酸量一定相等,也就是稀硫酸一定完全反应,而依据化学方程式的计算可知同质量的铝要比铁生成的氢气要多,故产生等质量的氢气铁完全反应而铝可能有剩余,故C错误;
D、由图示分析可知两者最终生成的氢气质量相等,所以消耗的酸量一定相等,也就是稀硫酸一定完全反应,而依据化学方程式的计算可知同质量的铝要比铁生成的氢气要多,故产生等质量的氢气铁完全反应而铝可能有剩余,故D正确;
故选项为:D.
B、利用方程式的计算求出消耗相同硫酸时需要铝铁的质量大小关系:
设19.6g的硫酸(100g,其溶质质量分数为19.6%)完全反应需要铝的质量为x,铁的质量为y
2Al+3H2SO4=Al2(SO4)3+3H2↑
54 294
x 19.6g
| 54 |
| x |
| 294 |
| 19.6g |
Fe+H2SO4=FeSO4+H2↑
56 98
y 19.6g
| 56 |
| y |
| 98 |
| 19.6g |
由此可以看出,产生等质量的氢气需要铁的质量大,而铁只有5.6g,铝剩余,故B错误;
C、由图示分析可知两者最终生成的氢气质量相等,所以消耗的酸量一定相等,也就是稀硫酸一定完全反应,而依据化学方程式的计算可知同质量的铝要比铁生成的氢气要多,故产生等质量的氢气铁完全反应而铝可能有剩余,故C错误;
D、由图示分析可知两者最终生成的氢气质量相等,所以消耗的酸量一定相等,也就是稀硫酸一定完全反应,而依据化学方程式的计算可知同质量的铝要比铁生成的氢气要多,故产生等质量的氢气铁完全反应而铝可能有剩余,故D正确;
故选项为:D.
点评:本题考查了金属与酸反应生成氢气的质量关系,完成此题,可以依据金属与酸反应的化学方程式,计算所需的金属与酸的质量关系,进而进行合理的判断.

练习册系列答案
相关题目
 18、将质量相等的铝粉和铁粉分别与同体积、同浓度的稀硫酸反应,反应情况如下图所示.有关叙述中正确的是( )
18、将质量相等的铝粉和铁粉分别与同体积、同浓度的稀硫酸反应,反应情况如下图所示.有关叙述中正确的是( )
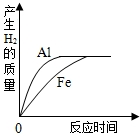 将质量相等的铝粉和铁粉分别与质量、浓度均相同的稀硫酸充分反应,下列所述的反应情况与图示可能相符的是( )
将质量相等的铝粉和铁粉分别与质量、浓度均相同的稀硫酸充分反应,下列所述的反应情况与图示可能相符的是( )