题目内容
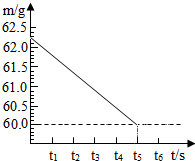 将碳酸钠和硫酸钠的固体混合物6g,放入烧杯中(烧杯质量为20g),再加入36.2g稀硫酸,在一定时间内恰好完全反应,无固体剩余.反应的时间(t)和烧杯及其所盛物质总质量(m)的关系如右图所示:
将碳酸钠和硫酸钠的固体混合物6g,放入烧杯中(烧杯质量为20g),再加入36.2g稀硫酸,在一定时间内恰好完全反应,无固体剩余.反应的时间(t)和烧杯及其所盛物质总质量(m)的关系如右图所示:(1)生成气体的质量为
(2)求所得溶液中溶质的质量分数.
分析:(1)因为碳酸钠与硫酸反应会生成二氧化碳,硫酸钠不反应,对于该过程而言反应前后装置减少的质量为二氧化碳的质量,其它均不能造成质量的变化.
(2)利用二氧化碳的质量可求碳酸钠的质量,则进一步可得到原混合物中硫酸钠的质量,再利用该反应可求生成的硫酸钠的质量,然后利用溶液中溶质的质量分数进行计算即可.
(2)利用二氧化碳的质量可求碳酸钠的质量,则进一步可得到原混合物中硫酸钠的质量,再利用该反应可求生成的硫酸钠的质量,然后利用溶液中溶质的质量分数进行计算即可.
解答:解:(1)二氧化碳的质量=62.2g-60g=2.2g
故答案为:2.2
(2)解:设生成硫酸钠的质量为x,原有碳酸钠的质量为y,
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
106 142 44
y x 2.2g
=
x=7.1g
=
y=5.3g
则原混合物中硫酸钠的质量是:6g-5.3g
所得溶液中溶质质量分数=
×100%=19.5%
故答案为:19.5%
故答案为:2.2
(2)解:设生成硫酸钠的质量为x,原有碳酸钠的质量为y,
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
106 142 44
y x 2.2g
| 142 |
| 44 |
| x |
| 2.2g |
| 106 |
| 44 |
| y |
| 2.2g |
则原混合物中硫酸钠的质量是:6g-5.3g
所得溶液中溶质质量分数=
| 6g-5.3g+7.1g |
| 6g+36.2g-2.2g |
故答案为:19.5%
点评:本题是一道有关化学方程式和溶质质量分数的综合计算题,第一小题是最基本的根据质量守恒定律的计算;第二小题比较难,解题关键是要先求出原混合物中碳酸钠的质量.

练习册系列答案
相关题目



