题目内容
9.如图是实验室制取气体的部分装置和仪器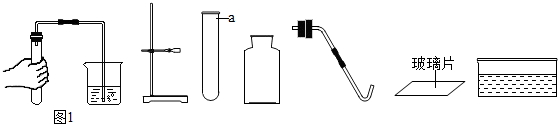
(1)仪器a的名称是试管;
(2)利用上述仪器完成高锰酸钾制氧气的实验必须补充的仪器是酒精灯写出发生反应的化学方程式2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+2O2↑;
(3)从图1中观察到的现象得出的结论该装置气密性良好;
(4)在实验室里,用大理石和盐酸反应制取二氧化碳
①用含碳酸钙100克的大理石和足量盐酸完全反应可生成CO244g;
②为了验证CO2与H2O反应及生成物的不稳定性,将制得的CO2通入紫色石蕊溶液,溶液变红,加热后仍然为红色,出现异常现象的可能原因是用较浓盐酸制二氧化碳.
分析 (1)要熟悉各种仪器的名称、用途和使用方法;
(2)高锰酸钾受热时容易扩散,分解能生成锰酸钾、二氧化锰和氧气;
(3)凡是有气体参加或产生的实验,实验前一定要检查装置的气密性;
(4)①根据化学方程式利用碳酸钙的质量求二氧化碳的质量;
②向盛有紫色石蕊试液的试管中通入适量的CO2,二氧化碳能与水反应生成碳酸,碳酸能使紫色石蕊试液变红色;将反应后的溶液加热,碳酸不稳定,受热分解生成二氧化碳和水,则石蕊溶液由红色变为紫色,氯化氢气体也能使紫色的石蕊试液变红色,加热后仍然为红色.
解答 解:(1)a是试管;
(2)用高锰酸钾制取氧气时需要加热,因此缺少酒精灯;
高锰酸钾受热分解的化学方程式为:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;
(3)图1实验操作是检查装置的气密性,以防装置漏气,影响实验,导管口有气泡冒出,说明装置不漏气;
(4)①设能生成二氧化碳的质量为x
CaCO3+2HCl=CaCl2+CO2↑+H2O
100 44
100g x
$\frac{100}{44}$=$\frac{100g}{\;}$
x=44g
答案:最多能得44克二氧化碳;
②向盛有紫色石蕊试液的试管中通入适量的CO2,二氧化碳能与水反应生成碳酸,碳酸能使紫色石蕊试液变红色;将反应后的溶液加热,碳酸不稳定,受热分解生成二氧化碳和水,则石蕊溶液由红色变为紫色,如果盐酸浓度大,反应过程中会有氯化氢气体与二氧化碳一同排出,氯化氢气体也能使紫色的石蕊试液变红色,加热后仍然为红色.
故答案为:(1)试管;
(2)酒精灯;
2KMnO4 $\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;
(3)该装置气密性良好(装置不漏气等,合理给分);
(4)①44;
②用较浓盐酸制二氧化碳(或制得的二氧化碳中含有氯化氢气体等合理即给分).
点评 本题主要考查仪器的用途、化学方程式的书写、检查气密性的方法的方面的知识,检查A装置气密性的方法是:将装置连接好后,先把导管口伸入水槽中,手握试管,观察导管口若有气泡冒出,即可证明装置不漏气.

| A. | 石油是不可再生能源 | B. | 进入林区严禁携带火种 | ||
| C. | 二氧化碳是空气污染物 | D. | 回收废旧金属可保护金属资源 |
| A. | 常用带火星的木条来检验空气中的O2 | |
| B. | 铁丝在O2里剧烈燃烧,火星四射,生成黑色固体 | |
| C. | 分离液态空气制取O2发生了分解反应 | |
| D. | 加热KClO3制O2,必须用MnO2作催化剂 |
(1)由推理可知:溶液A中的一定含有的溶质是Zn(NO3)2(填化学式)
写出一个你认为已发生的化学反应方程式:Zn+2AgNO3=Zn(NO3)2+2Ag.
(2)小强将固体B洗净,通过以下实验确定其成分,请将下表填写完整.
| 实验步骤 | 现象 | 实验结论 |
| 取少量固体B,滴加稀盐酸或稀硫酸 | 有较多气泡产生 | 固体B含有Zn、Ag、Cu |
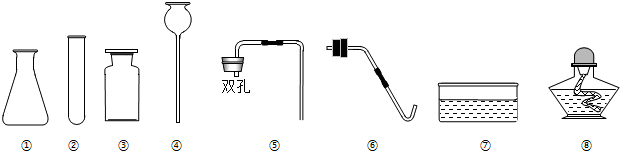
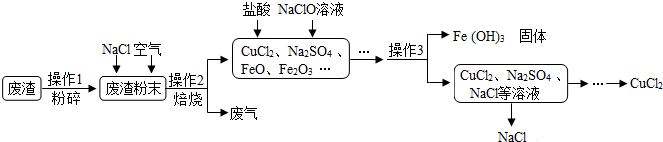 (1)操作1:为加大反应物的接触面积应将废渣粉碎.
(1)操作1:为加大反应物的接触面积应将废渣粉碎.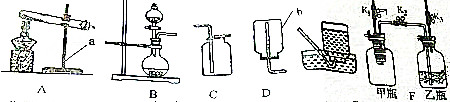 如图是实验室常用的实验装置,请根据要求填空:
如图是实验室常用的实验装置,请根据要求填空: