题目内容
【题目】有一瓶固体混合物样品,可能含氢氧化钠、氯化钠、硫酸钠、碳酸钠中的一种或几种。小敏同学为了探究其成分做了以下实验:
Ⅰ.取少量固体样品于烧杯中,先加足量水溶解,再加入足量的BaC12 溶液,有白色沉淀产生;
Ⅱ.继续向烧杯中逐滴加入稀盐酸并不断搅拌,烧杯内白色沉淀质量随加入稀盐酸质量的变化如图所示。请回答下列问题:
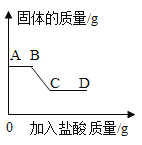
(1)AB 段发生反应的化学方程式:_____;
(2)D 点溶液中含有的溶质:_____。
【答案】NaOH+HCl=NaCl+H2O HCl、NaCl
【解析】
碳酸钠和氯化钡反应生成溶于酸的碳酸钡沉淀,硫酸钠和氯化钡反应生成不溶于酸的硫酸钡沉淀,取少量固体样品于烧杯中,先加足量水溶解,再加入足量的BaC12 溶液,有白色沉淀产生,所以样品中一定含有碳酸钠、硫酸钠中的一种或两种;
继续向烧杯中逐滴加入稀盐酸并不断搅拌,开始时,沉淀质量不变,所以样品中一定含有氢氧化钠,然后烧杯内白色沉淀质量随加入稀盐酸质量增加而逐渐减小,所以样品中一定含有碳酸钠和硫酸钠。
由分析可知(1)AB 段发生的反应是氢氧化钠和盐酸反应生成氯化钠和水,化学方程式为:NaOH+HCl=NaCl+H2O;
(2)D点溶液中含有的溶质:HCl、NaCl。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某化学兴趣小组为了测定某石灰石样品中碳酸钙的质量分数,取用2.0g石灰石样品,把25.0g稀盐酸分五次加入样品中(样品中的杂质既不与盐酸反应,也不溶解于水),每次充分反应后都经过滤、干燥、称量,得实验数据如下:
实验次数 | 1 | 2 | 3 | 4 | 5 |
稀盐酸的累计加入量 | 5.0g | 10.0g | 15.0g | 20.0g | 25.0g |
剩余固体的质量 | 1.5g | m | 0.5g | 0.3g | 0.3g |
计算:
(1)m=______g。
(2)石灰石中碳酸钙的质量分数为______。
(3)2.0g石灰石样品与足量稀盐酸反应,产生二氧化碳的质量是多少?_____(写出解题过程)