��Ŀ����
����Ŀ��Ϋ���б��ٲ����壬������Դ�ḻ������ǰ��ʮ��Զ��
��1�����ú����еı��Ǽ�ʳ�ο����Ƶô���ҹ��Ƽҵ������°����ˡ������Ƽ������ģ���������£�

��Ӧ�ٵĻ�ѧ����ʽ ����Ӧ�ڵĻ�ѧ����ʽΪ ����ҵ���÷���Һ̬�����ķ�����ȡ���������� �仯�����������ѧ������
��2������þ�㷺Ӧ�����������������ҵ���Ӻ�ˮ����ȡþ�Ĺ�����ͼ��ʾ��
![]()
������ת�������У��ٴ��������ķ�Ӧ�������ֻ�����Ӧ�����е� ��Ӧ��þԪ�صĻ��ϼ۷����仯���� ��Ӧ����д��Ӧ��ţ���
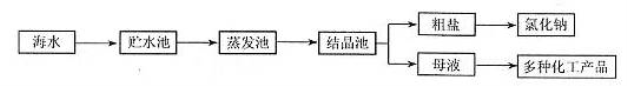
��3����ˮ�г����̺���������Ԫ�غ�þԪ���⣬�����д����ļ�Ԫ�ء�
�����ܽ�ȱ����ܽ�����ش��������⣺


���Ȼ��Ƶ��ܽ�������� ����ס����ҡ�����
��60��ʱ��100g ˮ�м���90g ����أ�����ܽ⣬������Һ�� ������͡������͡�����Һ����60���ĸ���Һ���µ�10��ʱ���������������Ϊ g��
���𰸡���1����CaCO3 ![]() CaO+CO2�� 2NaHCO3
CaO+CO2�� 2NaHCO3 ![]() Na2CO3+CO2��+H2O ������2�����ֽ� �� ��3������ �ڲ����� 69.1
Na2CO3+CO2��+H2O ������2�����ֽ� �� ��3������ �ڲ����� 69.1
��������
�����������1������ʯ��ʯ�Ļ�ѧ����ʽΪCaCO3 ![]() CaO+CO2����̼���������ȷֽ�Ļ�ѧ����ʽΪ2NaHCO3
CaO+CO2����̼���������ȷֽ�Ļ�ѧ����ʽΪ2NaHCO3 ![]() Na2CO3+CO2��+H2O����ҵ���÷���Һ̬�����ķ�����ȡ���������������仯����2���ں�ˮ��ȡ����þ�Ĺ����У�����ʯ����ת��Ϊ������þ�Ĺ������漰�ķ�Ӧ����Ϊ���ֽⷴӦ������þ�Ļ��ϼ۷����ı��Ϊ����Ȼ�þ���ɽ���þ�������ķ�Ӧ����3�����������ṩ�ı����֪���Ȼ��Ƶ��ܽ�����¶ȵ����߱仯���ʢ��Ȼ��Ƶ��ܽ�����������ߣ���60��ʱ��100g ˮ�м���90g ����أ�����ܽ⣬������Һ�Dz�������Һ����60���ĸ���Һ���µ�10��ʱ���������������Ϊ90g-20.9g=69.1g
Na2CO3+CO2��+H2O����ҵ���÷���Һ̬�����ķ�����ȡ���������������仯����2���ں�ˮ��ȡ����þ�Ĺ����У�����ʯ����ת��Ϊ������þ�Ĺ������漰�ķ�Ӧ����Ϊ���ֽⷴӦ������þ�Ļ��ϼ۷����ı��Ϊ����Ȼ�þ���ɽ���þ�������ķ�Ӧ����3�����������ṩ�ı����֪���Ȼ��Ƶ��ܽ�����¶ȵ����߱仯���ʢ��Ȼ��Ƶ��ܽ�����������ߣ���60��ʱ��100g ˮ�м���90g ����أ�����ܽ⣬������Һ�Dz�������Һ����60���ĸ���Һ���µ�10��ʱ���������������Ϊ90g-20.9g=69.1g