题目内容
【题目】胆矾晶体部分失水后得到某硫酸铜晶体(CuSO4xH2O),华雪同学为研究CuSO4xH2O加热后所得物质的组成,做了以下实验:取10.7gCuSO4xH2O晶体加热使其分解,绘制出固体的质量随温度的变化关系图.如图所示,到t1℃时该固体完全失去结晶水,化学方程式为:CuSO4xH2O ![]() CuSO4+xH2O↑.
CuSO4+xH2O↑. 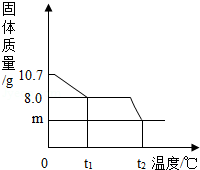
(1)计算该硫酸铜晶体(CuSO4xH2O)中x的值.(CuSO4xH2O的相对分子质量为:160+18x)
(2)CuSO4中铜元素的质量分数是多少?
(3)升温到t2℃,残留固体是黑色物质,则m=g.(写出求m的过程)
【答案】
(1)解:由图示数据和“到t1℃时该固体完全失去结晶水”可知,结晶水的质量为:10.7g﹣8.0g=2.7g
CuSO4xH2O | CuSO4+ | xH2O↑ |
160 | 18x | |
8g | 2.7g |
![]()
x=3;
(2)解:CuSO4中铜元素的质量分数= ![]() =40%;
=40%;
(3)4.0
【解析】(3)铜元素的质量=8.0g×40%=3.2g. 根据原子守恒,黑色物质中一定含有氧化铜,化学式CuO;
因为黑色物质是CuO,由Cu元素守恒得
m(CuO)=3.2g÷ ![]() =4.0g.
=4.0g.
答:(1)该硫酸铜晶体(CuSO4xH2O)中x的值为3;(2)CuSO4中铜元素的质量分数是40%;(3)升温到t2℃,残留固体是黑色物质,则m=4.0.
【考点精析】关于本题考查的根据化学反应方程式的计算,需要了解各物质间质量比=系数×相对分子质量之比才能得出正确答案.

【题目】在实验课中,各小组作了如下实验:
实验编号 | 1 | 2 | 3 | 4 |
实验操作 |
|
|
|
|
实验后,同学们按老师要求将废液都倒在指定的大烧杯中,小科猜想该烧杯中的废液可能有硫酸铜、硫酸锌、硫酸亚铁…,应该可以从中提炼出铁和铜.经思考后,他设计了如图所示的实验,并设法使滤液甲和乙所含的溶质相同.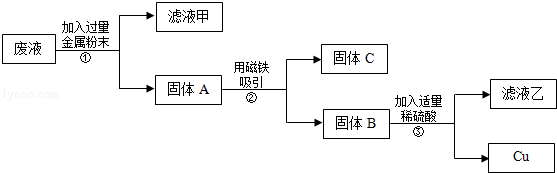
则固体C是 , 操作③的名称是 , 实验中所加的过量金属粉末是 .