题目内容
(2010?昆明模拟)某盐场生产的食盐产品中含有氯化钙杂质.某化学兴趣小组为测定该食品产品中氯化钠的质量分数,进行了如下实验:取100 g食盐样品完全溶解于水,逐滴加入碳酸钠溶液,反应关系如图所示:(1)发生反应的化学方程式为______;
(2)图中x=______;
(3)求该食盐产品中氯化钠的质量分数?为______%(计算结果保留到小数点后一位)

【答案】分析:由图象可知,当生成沉淀的质量为2克时,食盐中的氯化钙恰好完全反应,根据此时沉淀的质量可求得氯化钙的质量.根据消耗的碳酸钠溶液质量与生成沉淀的质量成正比例关系,可求加入5.3克碳酸钠溶液时所生成沉淀的质量.
解答:解:(1)氯化钠与碳酸钠不反应,所以发生反应的方程式为CaCl2+Na2CO3═CaCO3↓+2NaCl.
(2)当生成2克沉淀时,消耗碳酸钠溶液21.2克,按比例关系,则有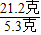 =
=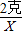 ,X=0.5克
,X=0.5克
(3)设食盐产品中氯化钙的质量为y,则
CaCl2+Na2CO3═CaCO3↓+2NaCl
111 100
y 2克
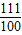 =
=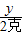 ,y=2.22克
,y=2.22克
100克-2.22克=97.78克,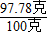 ×100%=97.8%.
×100%=97.8%.
答:该食盐产品中氯化钠的质量分数97.8%
故答案为:(1)CaCl2+Na2CO3═CaCO3↓+2NaCl; (2)0.5; (3)97.8%.
点评:对于带有图象或图表的计算题,在近年的中考中出现频度较高,能对图象或图表进行分析得出所需信息是解题的关键.
解答:解:(1)氯化钠与碳酸钠不反应,所以发生反应的方程式为CaCl2+Na2CO3═CaCO3↓+2NaCl.
(2)当生成2克沉淀时,消耗碳酸钠溶液21.2克,按比例关系,则有
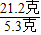 =
=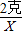 ,X=0.5克
,X=0.5克(3)设食盐产品中氯化钙的质量为y,则
CaCl2+Na2CO3═CaCO3↓+2NaCl
111 100
y 2克
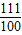 =
=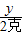 ,y=2.22克
,y=2.22克100克-2.22克=97.78克,
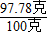 ×100%=97.8%.
×100%=97.8%.答:该食盐产品中氯化钠的质量分数97.8%
故答案为:(1)CaCl2+Na2CO3═CaCO3↓+2NaCl; (2)0.5; (3)97.8%.
点评:对于带有图象或图表的计算题,在近年的中考中出现频度较高,能对图象或图表进行分析得出所需信息是解题的关键.

练习册系列答案
 全能练考卷系列答案
全能练考卷系列答案
相关题目