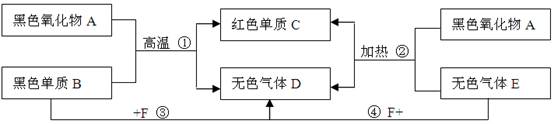
题目内容
(9分) 在实验室里常采用过氧化氢和二氧化锰混合的方法制取氧气。请回答下列问题:
(1)反应的化学方程式为 。
(2)用下图所给仪器可以组装出多套氧气的发生装置和收集装置。请你组装一套氧气的发生装置和收集装置,写出所选择的仪器编号 。
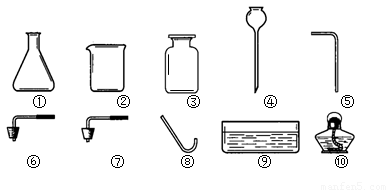
(3)简要说明你组装的气体发生装置的优点 。
(4)用你组装的装置收集氧气,如何知道氧气已收集满?
。
(5)这套气体发生装置也可以用来制取二氧化碳。如果选用碳酸钠粉末和稀盐酸来制取二氧化碳,为了控制反应速率,应对该气体发生装置如何改进?(可另增仪器)
。
 |
(1)2H2O2 2H2O+O2↑ (2分)
(2)①③⑤⑦(A套) ①③⑦⑧⑨(B套)
①③④⑤⑥(C套) ①③④⑥⑧⑨(D套)(2分)
(3)装置简单(对应A、B套装置);添加药品方便(对应C、D套装置)。(1分)
(4)将带火星的木条放在集气瓶口复燃(对应A、C套装置);集气瓶口有气泡冒出(对应B、D套装置)。(2分)
(5)用分液漏斗(或注射器)加入酸液(能控制反应速率的改进方案均可)(2分)
【解析】:(1)反应的化学方程式为:2H2O2
 2H2O+O2↑
2H2O+O2↑
(2)因为用过氧化氢和二氧化锰混合的方法制取氧气,是固液不加热的反应,所以可用①⑤(7)组装制取氧气的发生装置,③装置可以收集氧气.组装的装置有①③⑤(7).
(3)装置的优点是:装置简单.
(4)检验是否收集满的方法是:将带火星的木条放在集气瓶口,如果带火星的木条复燃说明已经收集满.
(5)分液漏斗或注射器能够控制液体的滴加速率.

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案
 铁、铝、铜是日常生活中使用最广泛的金属.
铁、铝、铜是日常生活中使用最广泛的金属.