题目内容
 下列数据是硝酸钾固体在不同温度时的溶解度.
下列数据是硝酸钾固体在不同温度时的溶解度.
| 温度/℃ | 0 | 20 | 40 | 60 | 80 |
| 溶解度/g | 13.3 | 31.6 | 63.9 | 110 | 169 |
(2)20℃时,向100g水中加入31.6g硝酸钾,充分溶解后得到________(填“饱和”或“不饱和”)溶液.
(3)20℃时,向100g水中加入40g硝酸钾,若使硝酸钾完全溶解,可以采用的方法是________.
(4)某标签上 标有“16%的硝酸钾溶液”,由该标签可获得的信息是________、________.
(5)右图是同学们根据所学知识设计的一个趣味实验,请参与实验并回答问题:将分液漏斗里适量的水加入大试管中,使足够量的氢氧化钠固体完全溶解后,能观察到的现象是________;请解释产生上述现象的主要原因是________.
解:(1)通过表中数据可发现,当温度不断升高时,硝酸钾的溶解度不断增大,说明硝酸钾的溶解度随温度升高而增大;从表格还可以得到几种温度下的溶解度及溶解度的大小关系等;故答案为:硝酸钾的溶解度随温度的升高而增大(其它合理答案也给分);
(2)20℃时硝酸钾的溶解度为31.6g,即此时100g水溶解31.6g硝酸钾恰好成为饱和溶液;故答案为:饱和;
(3)20℃时硝酸钾的溶解度为31.6g,即此时100g水溶解硝酸钾达饱和时只能溶解31.6g;因此,要使100g水完全溶解40g硝酸钾,可采取继续加入一定量的水的方法,故答案为:加水;
(4)16%指得是溶液中溶质的质量分数,等于溶质与溶剂的质量比,故答案为:该溶液中溶质是硝酸钾、溶剂是水;该溶液中溶质与溶剂的质量比是16:100;
(5)氢氧化钠固体溶于水放热,试管内温度升高,气体压强增大,温度的变化会引起溶解度的变化,根据曲线内容:硝酸钾溶解度随温度升高而增大,所以固体会溶解,故答案为:U型管中a液面下降b液面上升、烧杯中硝酸钾晶体部分溶解;氢氧化钠固体溶于水放热,试管内温度升高,气体压强增大,导致液面变化;烧杯内溶液温度升高,硝酸钾溶解度随温度升高而增大,所以部分硝酸钾晶体溶解.
分析:(1)对比表中温度变化与硝酸钾的溶解度的变化情况,找出相关的规律性;
(2)根据20℃时硝酸钾的溶解度为31.6g,判断100g水中溶解31.6g硝酸钾是否形成饱和溶液;
(3)根据20℃时硝酸钾的溶解度为31.6g,判断100g水能否完全溶解40g硝酸钾以及要完全溶解可采取的方法;
(4)可以用溶质的质量分数表示溶液的组成;
(5)氢氧化钠固体溶于水放热,气体热胀冷缩,温度的变化会引起溶解度的变化.
点评:物质的溶解度是指在一定温度下,100g水所能溶解该溶质的最大值;因此,可使用某温度下的溶解度判断该温度时一定量水中所能溶解该物质的最多质量.
(2)20℃时硝酸钾的溶解度为31.6g,即此时100g水溶解31.6g硝酸钾恰好成为饱和溶液;故答案为:饱和;
(3)20℃时硝酸钾的溶解度为31.6g,即此时100g水溶解硝酸钾达饱和时只能溶解31.6g;因此,要使100g水完全溶解40g硝酸钾,可采取继续加入一定量的水的方法,故答案为:加水;
(4)16%指得是溶液中溶质的质量分数,等于溶质与溶剂的质量比,故答案为:该溶液中溶质是硝酸钾、溶剂是水;该溶液中溶质与溶剂的质量比是16:100;
(5)氢氧化钠固体溶于水放热,试管内温度升高,气体压强增大,温度的变化会引起溶解度的变化,根据曲线内容:硝酸钾溶解度随温度升高而增大,所以固体会溶解,故答案为:U型管中a液面下降b液面上升、烧杯中硝酸钾晶体部分溶解;氢氧化钠固体溶于水放热,试管内温度升高,气体压强增大,导致液面变化;烧杯内溶液温度升高,硝酸钾溶解度随温度升高而增大,所以部分硝酸钾晶体溶解.
分析:(1)对比表中温度变化与硝酸钾的溶解度的变化情况,找出相关的规律性;
(2)根据20℃时硝酸钾的溶解度为31.6g,判断100g水中溶解31.6g硝酸钾是否形成饱和溶液;
(3)根据20℃时硝酸钾的溶解度为31.6g,判断100g水能否完全溶解40g硝酸钾以及要完全溶解可采取的方法;
(4)可以用溶质的质量分数表示溶液的组成;
(5)氢氧化钠固体溶于水放热,气体热胀冷缩,温度的变化会引起溶解度的变化.
点评:物质的溶解度是指在一定温度下,100g水所能溶解该溶质的最大值;因此,可使用某温度下的溶解度判断该温度时一定量水中所能溶解该物质的最多质量.

练习册系列答案
相关题目

 28、下列数据是硝酸钾固体在不同温度时的溶解度.
28、下列数据是硝酸钾固体在不同温度时的溶解度.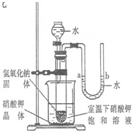 下列数据是硝酸钾固体在不同温度时的溶解度.
下列数据是硝酸钾固体在不同温度时的溶解度.