题目内容
将一定量的丙醇(C3H8O)和氧气置于一个封闭的容器巾引燃,测得反应前后各物质的质量如表:
表中a的值为 ,参加反应的氧气和二氧化碳的质量比 ,X中一定含有 元素.
| 物质 | 丙醇 | 氧气 | 水 | 二氧化碳 | X |
| 反应前质量/g | 6.0 | 14.8 | o | 0.4 | o |
| 反应后质量/g | 0 | 2 | 7.2 | 9.2 | a |
考点:质量守恒定律及其应用
专题:化学用语和质量守恒定律
分析:化学反应遵循质量守恒定律,即参加反应的物质的质量之和,等于反应后生成的物质的质量之和.
解答:解:a=6.0+(14.8-2)-7.2-(9.2-0.4)=2.8;
参加反应的氧气和二氧化碳的质量比为:(14.8g-2g):(9.2g-0.4g)=16:11;
6.0g丙醇中碳元素的质量为:6.0g×
×100%=3.6g,
氢元素的质量为:6.0g×
×100%=0.8g,
氧元素的质量为:6.0g×
×100%=1.6g,
7.2g水中氢元素的质量为:7.2g×
×100%=0.8g,
氧元素的质量为:7.2g-0.8g=6.4g,
8.8g二氧化碳中碳元素的质量为:8.8g×
×100%=2.4g,
氧元素的质量为:8.8g-2.4g=6.4g,
X中碳元素的质量为:3.6g-2.4g=1.2g,
氧元素的质量为:1.6g+12.8g-6.4g-6.4g=1.6g,
因此X中含有碳元素和氧元素.
故填:2.8;16:11;碳、氧.
参加反应的氧气和二氧化碳的质量比为:(14.8g-2g):(9.2g-0.4g)=16:11;
6.0g丙醇中碳元素的质量为:6.0g×
| 36 |
| 60 |
氢元素的质量为:6.0g×
| 8 |
| 60 |
氧元素的质量为:6.0g×
| 16 |
| 60 |
7.2g水中氢元素的质量为:7.2g×
| 2 |
| 18 |
氧元素的质量为:7.2g-0.8g=6.4g,
8.8g二氧化碳中碳元素的质量为:8.8g×
| 12 |
| 44 |
氧元素的质量为:8.8g-2.4g=6.4g,
X中碳元素的质量为:3.6g-2.4g=1.2g,
氧元素的质量为:1.6g+12.8g-6.4g-6.4g=1.6g,
因此X中含有碳元素和氧元素.
故填:2.8;16:11;碳、氧.
点评:化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、进行相关方面计算的基础.

练习册系列答案
相关题目
影响蔗糖在水中溶解的因素很多,当我们研究蔗糖颗粒大小对溶解快慢的影响时,需控制的影响因素有( )
| A、水量的多少 | B、温度的高低 |
| C、是否搅拌 | D、以上全部 |
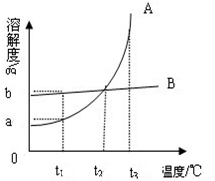 如图是A、B两种固体物质的溶解度曲线.请回答下列问题:
如图是A、B两种固体物质的溶解度曲线.请回答下列问题: 与
与 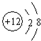 两种离子形成的化合物的化学式是
两种离子形成的化合物的化学式是
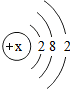 某元素原子结构示意图如图,则x的值为
某元素原子结构示意图如图,则x的值为 如图表示一瓶硫酸锌溶液,请用正确的化学用语填空:
如图表示一瓶硫酸锌溶液,请用正确的化学用语填空: 图中都是初中化学常见物质,其中A、B为单质,甲、乙、丙、丁是化合物,甲和乙组成元素相同且通常为液态,丙和丁组成元素相同且通常为气态.图中“-”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系;部分反应物或生成物已略去.
图中都是初中化学常见物质,其中A、B为单质,甲、乙、丙、丁是化合物,甲和乙组成元素相同且通常为液态,丙和丁组成元素相同且通常为气态.图中“-”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系;部分反应物或生成物已略去.