题目内容
为测定一瓶久置的烧碱中氢氧化钠的含量,某同学取25.0g样品,溶于水得到100g溶液,再加入100g足量稀硫酸,充分反应至不再产生气体,测得溶液质量为197.8g.
请计算:
(1)反应产生CO2的质量.
(2)样品中NaOH的质量分数.(计算结果精确到0.1%)
解:
(1)CO2的质量=100 g+100 g-197.8 g=2.2g
(2)设样品中碳酸钠的质量为x
Na2CO3+H2SO4═Na2SO4+H2O+CO2↑
106 44
x 2.2g
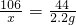
x=5.3 g
则样品中NaOH的质量为:25g-5.3 g=19.7 g
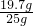 ×100%=78.8%
×100%=78.8%
答:反应产生的CO2的质量为2.2g;样品中NaOH的质量分数为78.8%;
分析:(1)根据质量守恒定律,反应过程中所生成的气体的质量等于反应前后溶液质量的减少量;
(2)样品中NaOH的质量分数等于样品中NaOH的质量除以样品的总质量,所以我们可以根据上一步所求得二氧化碳的质量,根据质量守恒定律,求得样品中NaOH的质量,而后再求样品中NaOH的质量分数;
点评:此题主要是在碱的化学性质的基础上考查有关质量守恒定律的有关知识,以及混合物中质量分数的计算问题,注重学生综合能力的培养,是中考的考点之一.
(1)CO2的质量=100 g+100 g-197.8 g=2.2g
(2)设样品中碳酸钠的质量为x
Na2CO3+H2SO4═Na2SO4+H2O+CO2↑
106 44
x 2.2g
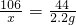
x=5.3 g
则样品中NaOH的质量为:25g-5.3 g=19.7 g
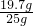 ×100%=78.8%
×100%=78.8%答:反应产生的CO2的质量为2.2g;样品中NaOH的质量分数为78.8%;
分析:(1)根据质量守恒定律,反应过程中所生成的气体的质量等于反应前后溶液质量的减少量;
(2)样品中NaOH的质量分数等于样品中NaOH的质量除以样品的总质量,所以我们可以根据上一步所求得二氧化碳的质量,根据质量守恒定律,求得样品中NaOH的质量,而后再求样品中NaOH的质量分数;
点评:此题主要是在碱的化学性质的基础上考查有关质量守恒定律的有关知识,以及混合物中质量分数的计算问题,注重学生综合能力的培养,是中考的考点之一.

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
相关题目