题目内容
 在烧杯中加入一枚久置的铁钉,再滴加稀硫酸,放出气体的质量与所加稀硫酸质量的关系如图所示.请回答下列问题:
在烧杯中加入一枚久置的铁钉,再滴加稀硫酸,放出气体的质量与所加稀硫酸质量的关系如图所示.请回答下列问题:(1)产生氢气
(2)试计算参加反应的铁的质量.
考点:根据化学反应方程式的计算
专题:有关化学方程式的计算
分析:由于铁的化学性质比较活泼,易于空气中的氧气反应,在铁的表面形成了氧化铁,所以开始加入硫酸时不产生氢气.当加入9.8g稀硫酸时才产生氢气,当加稀硫酸的量至107.8g时,铁钉和硫酸恰好完全反应,产生0.2g氢气.根据铁钉和稀硫酸反应化学方程式,由氢气的质量,可求出铁的质量.
解答:解:(1)根据铁钉和稀硫酸反应化学方程式,结合题干中的右图所示知道产生氢气的质量是0.2g,刚开始滴加稀硫酸没有氢气放出的原因是:久置的铁钉表面被氧化,形成一层氧化膜.此氧化膜与硫酸反应生成硫酸铁和水,不产生氢气;故填:0.2;稀硫酸首先与表面的氧化铁发生了反应;
(2)设参加反应的铁的质量为x.
Fe+H2SO4═FeSO4+H2↑
56 2
x 0.2g
=
解得:x=5.6g
答:参加反应的铁的质量为5.6g.
(2)设参加反应的铁的质量为x.
Fe+H2SO4═FeSO4+H2↑
56 2
x 0.2g
| 56 |
| x |
| 2 |
| 0.2g |
解得:x=5.6g
答:参加反应的铁的质量为5.6g.
点评:此题考查学生会结合图示找出解题突破口,利用化学方程式进行计算,特别是解2步时,首先化学方程式要正确,再者相对分子质量要计算正确,才能解出正确的答案.请同学们考虑细致,思维要慎密.

练习册系列答案
相关题目
下列关于相对原子质量的说法不正确的是( )
| A、相对原子质量单位为1 |
| B、相对原子质量是一个比值 |
| C、相对原子质量就是原子的实际质量 |
| D、相对原子质量代表各类原子实际质量的相对大小 |
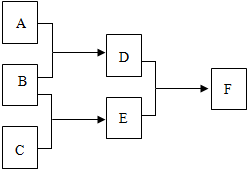
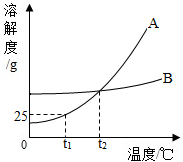 A、B两物质的溶解度曲线如图所示,请根据曲线回答下列问题:
A、B两物质的溶解度曲线如图所示,请根据曲线回答下列问题:
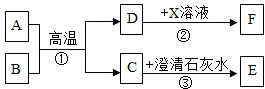 A-F和X都是初中化学中的常见物质,其中A、C是无色气体且组成物质的元素种类相同,B、F是红色固体,它们的转化关系如图所示(部分生成物已省略):
A-F和X都是初中化学中的常见物质,其中A、C是无色气体且组成物质的元素种类相同,B、F是红色固体,它们的转化关系如图所示(部分生成物已省略):