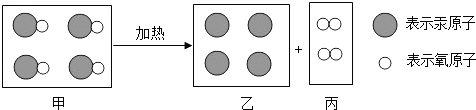
题目内容
【题目】金属材料在工农业生产、日常 生活中有着广泛应用.请根据所学知识填空:
(1)铝制品不易锈蚀的原因是铝与氧气作用,在表面形成了致密的保护膜,这种保护膜的化学成分用化学式表示为 .
(2)回收利用废金属是解决废金属造成资源浪费和不同程度的环境污染的方法之一.某化工厂处理回收含铜废料的生产流程与部分操作如下: 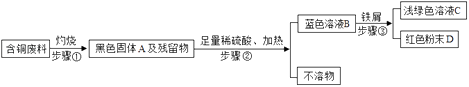
(注:步骤①得到的残留物不溶于水和稀硫酸)
①黑色固体A的化学式是;
②写出步骤③反应的化学方程式;
③通常在步骤③必须加入略过量的“铁屑”,原因是 .
【答案】
(1)Al2O3
(2)CuO;Fe+CuSO4═Cu+FeSO4;使CuSO4溶液充分反应
【解析】解:(1)铝和氧气反应生成氧化铝,故填:Al2O3;(2)①黑色固体A和稀硫酸反应生成蓝色溶液B,所以B中含有铜离子,A是氧化铜,化学式为:CuO;②铁和硫酸铜反应生成硫酸亚铁和铜,铁和硫酸反应生成硫酸亚铁和氢气,化学方程式为:Fe+CuSO4═Cu+FeSO4;③加入过量的铁实际是将硫酸铜全部转化成硫酸亚铁.所以答案是:①CuO;②Fe+CuSO4═Cu+FeSO4;③使CuSO4溶液充分反应.
【考点精析】解答此题的关键在于理解金属材料的选择依据的相关知识,掌握黑色金属:通常指铁、锰、铬及它们的合金.重金属:如铜、锌、铅等;有色金属轻金属:如钠、镁、铝等;有色金属:通常是指除黑色金属以外的其他金属,以及对书写化学方程式、文字表达式、电离方程式的理解,了解注意:a、配平 b、条件 c、箭号.

 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案【题目】某兴趣小组同学对碱式碳酸铜的分解产物进行探究.
【查阅资料】
①碱式碳酸铜受热分解的化学方程式为::Cu2(OH)2CO3 ![]() 2CuO+H2O+CO2↑;
2CuO+H2O+CO2↑;
②白色的无水硫酸铜遇水会变成蓝色.
(1)【实验验证】验证碱式碳酸铜的分解产物,可选装置如图所示. 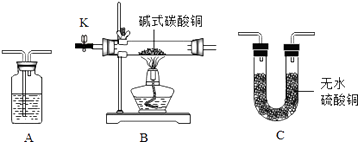
①如图装置A中盛放的试剂名称是 .
②甲同学将装置按(填字母,且每套装置限用一次)顺序组合进行实验,验证出碱式碳酸铜的分解产物中有二氧化碳和水.
③B装置中粉末完全变黑后,乙同学为确认该黑色粉末是氧化铜而不是碳粉,设计如下实验,请完成下表:
实验步骤 | 观察到的现象 | 获得结论 | 有关反应的化学方程式 |
取少量黑色粉末于试管中,向其中加入足量的稀硫酸,振荡 | 黑色粉末均为氧化铜 |
(2)【拓展探究】
丙同学利用上述实验后的B装置(包括其中药品),探究CO还原CuO所得固体产物的成分,实验装置如图: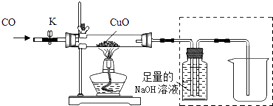
①实验过程
打开K,缓缓通入CO气体,一段时间后加热.当黑色固体全部变红后停止加热,继续通入CO气体直至玻璃管冷却.
②实验反思:上述实验装置中存在一处缺陷为:
③表达交流:下列有关该实验的说法正确的是
A.该实验最好在通风橱中进行
B.先通入一会CO再加热是为了排净装置中的空气
C.排入到烧杯中的溶液可能显碱性,也可能显中性.