题目内容
(2013?雅安)对比学习有利于发现事物的共性与个性.为探究酸的性质,同学们进行了如下实验.
清洗试管时,小乔同学将C、F两试管中的无色液体同时倒入一个洁净的废液缸,废液缸中立刻冒气泡并出现白色沉淀.请分析上述现象并回答:
Ⅰ.废液缸中产生气体的化学方程式为
Ⅱ.废液缸里最终产生的白色沉淀中一定有硫酸钡,可能有
| 实验内容 | 实验现象 | 分析与结论 |
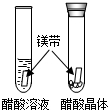 |
醋酸晶体试管内 无现象或无明显现象 无现象或无明显现象 ,醋酸溶液试管中镁带表面冒气泡. |
酸的很多反应通常在水溶液中才能完成. |
用玻璃棒蘸硫酸在白纸上写字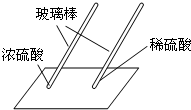 |
浓 浓 (填“浓”或“稀”)硫酸使白纸炭化. |
即使是同种酸,由于 浓度或溶质质量分数 浓度或溶质质量分数 不同,它们的性质不完全相同. |
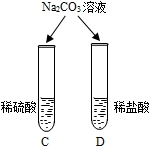 |
两试管中均产生 气泡 气泡 |
不同的酸具 有相似的性质,这是因为酸的组成中都含有 H+ H+ (填元素符号). |
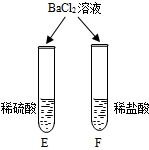 |
E试管中产生 白色沉淀 白色沉淀 ,F试管中无明显现象. |
不同的酸根会导致酸的“个性”差异.因此,可用氯化钡溶液鉴别盐酸和硫酸. |
Ⅰ.废液缸中产生气体的化学方程式为
2HCl+Na2CO3═2NaCl+H2O+CO2↑
2HCl+Na2CO3═2NaCl+H2O+CO2↑
.Ⅱ.废液缸里最终产生的白色沉淀中一定有硫酸钡,可能有
BaCO3
BaCO3
(填化学式).分析:金属可以和酸液反应,但是不能酸的固体反应,浓硫酸具有吸水性可以使纸张碳化,稀硫酸和稀盐酸都能够和碳酸钠反应生成气体,稀硫酸可以和氯化钡反应生成沉淀,但是稀盐酸不能,可以据此结合题给的信息进行解答.
解答:解:酸的很多反应通常在水溶液中才能完成,因此盛有醋酸晶体的试管内无明显现象,盛有醋酸溶液的试管中镁带表面冒气泡;
浓硫酸可以是纸张碳化,而稀硫酸不能,说明即使是同种酸,由于溶质质量分数不同,它们的性质不完全相同;
向C和D两试管中加入碳酸钠,都会产生气泡,说明不同的酸因为组成中都含有氢离子而具有相似的性质;
E试管中氯化钡和稀硫酸反应产生白色沉淀,F试管中盐酸和氯化钡不反应,无明显现象,说明不同的酸根会导致酸的“个性”差异;
Ⅰ、废液缸中立刻冒气泡,说明C中碳酸钠过量,CF试管中的液体混合后,碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,反应的化学方程式为:Na2CO3+2HCl═2NaCl+H2O+CO2↑;
Ⅱ、C中试管中碳酸钠和硫酸反应生成硫酸钠,废液缸里除了硫酸钠和氯化钡反应产生的白色沉淀外,若过量的碳酸钠和稀盐酸反应后还有剩余,那么碳酸钠还会和氯化钡反应生成碳酸钡沉淀;
故答案为:
Ⅰ、2HCl+Na2CO3═2NaCl+H2O+CO2↑;
Ⅱ、BaCO3.
浓硫酸可以是纸张碳化,而稀硫酸不能,说明即使是同种酸,由于溶质质量分数不同,它们的性质不完全相同;
向C和D两试管中加入碳酸钠,都会产生气泡,说明不同的酸因为组成中都含有氢离子而具有相似的性质;
E试管中氯化钡和稀硫酸反应产生白色沉淀,F试管中盐酸和氯化钡不反应,无明显现象,说明不同的酸根会导致酸的“个性”差异;
Ⅰ、废液缸中立刻冒气泡,说明C中碳酸钠过量,CF试管中的液体混合后,碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,反应的化学方程式为:Na2CO3+2HCl═2NaCl+H2O+CO2↑;
Ⅱ、C中试管中碳酸钠和硫酸反应生成硫酸钠,废液缸里除了硫酸钠和氯化钡反应产生的白色沉淀外,若过量的碳酸钠和稀盐酸反应后还有剩余,那么碳酸钠还会和氯化钡反应生成碳酸钡沉淀;
故答案为:
| 实验内容 | 实验现象 | 分析与结论 |
| 无现象或无明显现象 | ||
| 浓 | 浓度或溶质质量分数 | |
| 气泡 | H+ | |
| 白色沉淀 |
Ⅱ、BaCO3.
点评:这类题目主要是结合问题情景,通过分析、提炼常见酸碱的物理特性和化学性质,来补全实验设计中的空白,或者科学地设计实验方案,或者进行简单计算等等.要想解答好这类题目,就必须根据所学认真、规范地填写好每一个小题.特别是猜想、操作、现象的描述要准确、精炼,绝不可出现错别字;化学方程式的书写和计算都要严格按照步骤正确的进行书写和计算,切不可丢三落四.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目