��Ŀ����
����Ŀ�����������������ʱ�������й�����������չ��������·������������Ϊ���ǵij����ṩ�˷��㡣�й��ĸ������������������й���Ҳ�ս��츣��ȫ���ࡣ�����Żش��������⣺

��1�������������ij��������ܶ�С������ʴ�Ժõ����ʣ�Ӧѡ��ĺϽ�_____������A��B��C��ѡ�
A �̸� B ���Ͻ� C �����
��2�������ڹ��������е�����ת��Ϊ_____��
��3����������ʱ�ĽӴ�������ͭ��ͭ�Ͻ��ߣ�������ͭ�ǵ�������ͭ����Ҫ������������Ҫ��һ������������ͭ��Cu2O��������ͭ��Cu2S�����·�Ӧ���ɸߴ��ȵ�ͭ��һ����̬������Ⱦ�������Ӧ�Ļ�ѧ����ʽ��_____���÷�Ӧǰ��ͭԪ�صĻ��ϼ۱仯Ϊ_____��
��4�������Ľ��ɽ������еĽ�ͨѹ��������������������������Ⱦ����ŷţ���һ����̼��δȼ�յ�̼�⻯���_____����Ǧ�����_____��
���𰸡�B ����ת��Ϊ��е�� 2Cu2O+Cu2S![]() 6Cu+SO2�� +1�ۡ�0�� ���������� �̳�
6Cu+SO2�� +1�ۡ�0�� ���������� �̳�
��������
��1�����Ͻ�ʴ�Ժã��ܶ�С������Ҫ��Ͻ���Ͽ���ʴ���ܶ�С�����B��
��2����������ͨ���ǵ���������������ʻ�����е�����ת���ǵ���ת��Ϊ��е�ܣ��������ת��Ϊ��е�ܣ�
��3�����������Ϣ�Լ�Ԫ���غ��֪�������ɶ����������塣�ڻ������и�Ԫ���������ϼ۵Ĵ�����Ϊ�㣬������ͭ��Cu2O���У���Ԫ���ԩ�2�ۣ�������ͭԪ����+1�ۣ�����ͭ��Cu2S���У���Ԫ���ԩ�2�ۣ�������ͭԪ����+1�ۣ�ͭ���ڵ��ʣ�������Ԫ�صĻ��ϼ�Ϊ�㡣���2Cu2O+Cu2S ![]() 6Cu+SO2����+1�ۡ�0�ۣ�
6Cu+SO2����+1�ۡ�0�ۣ�
��4������β���к���δȼ�յ�̼�⻯���һ����̼�������������Ǧ����������̳��ȣ��������������̳���

����Ŀ��ijУ�о�С���������ȷֽ��������̽����
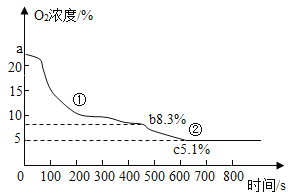
[̽��һ]��һС��ͨ����������������̽�������Ƴ�����Ũ�����¶ȵı仯��ͼ��ʾ��
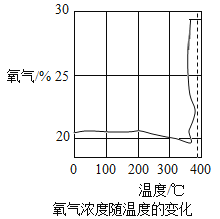
�������ϣ�KClO3���۵�ԼΪ356��C��MnO2�ķֽ��¶�ԼΪ535��C���þƾ��Ƹ����ʼ��ȣ��������ʵ��¶�һ��ԼΪ400��C���ң���ͼ�п�֪��KClO3�ֽ��¶�_____(�>������=����<��)���۵㡣��KCIO3�ֽ�ǰ���������õ�����Ũ�Ƚ��͵Ŀ���ԭ����____��
[̽����]�ڶ�С�鷢�֣������������ͭ��ϼ��ȣ�Ҳ�ܽϿ�������������ǣ����±�����ʵ��̽�������ⶨ�ֽ��¶ȡ�
ʵ���� | ʵ����Ʒ | �ֽ��¶� |
�� | 3.0g����� | 580 |
�� | 3.0g����غ�1.0g�������� | 350 |
�� | xg����غ�1.0g����ͭ | 370 |
(1)ʵ��3��x��ֵӦΪ_____���ɶԱ�ʵ��____(����)��֤������ͭҲ��ӿ�����صķֽ⣬����Ч�����õ�������_____��
(2)��̽��������ͭ������һ����������طֽ����ʹ�ϵ��ʱ���ó��й�ʵ����������:
����ͭ������ص������� | 1/40 | 1/20 | 1/10 | 1/5 | 1/3 | 1/2 | 2/3 | 1/1 | 2/1 |
����1L���������ʱ��(s) | 124 | 79 | 50 | 54 | 75 | 93 | 106 | 153 | 240 |
�������ݣ�����ͭ������ص�������Ϊ____ʱ����Ӧ������졣��ˣ��ڻ�ѧ��Ӧ�д���������_____ (��ǡ����ǡ�)Խ��Խ�á�
[̽����]����С����������غͶ���������ȡ����ʱ���������ɵ������Դ���ɫ�����д̼�����ζ��
������⣺���ɵ������г������������ʲô����?
�������ϣ��ٳ����£������ǻ���ɫ�����������ǻ�ɫ������ǿ�Ҵ̼�����ζ�����壻
�ڶ������Ⱦ���ǿ�����ԣ�������������Һ��Ӧ���ɲ�����ˮ�Ķ������̣����������ܡ�
������裺
����1����������������2�����ж������ȡ�
���ʵ�飺
ʵ�鲽�� | ʵ������ | ʵ����� |
____ | _____ | ����2��ȷ |
����Ŀ��2018��5��18���ҹ���һ�ҹ�����ĸ�Ժ��ɹ�����ĸ���������Ԫ��ʹ���˻�ͭ��Ϊ�ⶨij��ͭ(����Ͻ��н���ͭ��п)��ͭ��������������ȤС��ͬѧ��ȡ20g��ͭ��ĩ���ձ��У���80gϡ������Ĵμ��룬��ַ�Ӧ�����ʵ���������±���ʾ:
��һ�� | �ڶ��� | ������ | ���Ĵ� | |
����ϡ���������(g) | 20 | 20 | 20 | 20 |
�ձ���ʣ���������(g) | 39.92 | 59.84 | 79.80 | 99.80 |
(1)��ͭ��ĩ��ȫ��Ӧ����������������Ϊ_______g��
(2)�û�ͭ��ͭ����������Ϊ����____________? (д���������)
(3)������ʵ�������ʵ�����Ϊ________________��