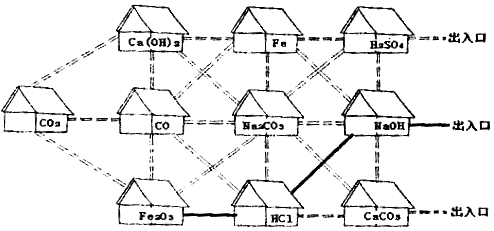
题目内容
【题目】碳和氧化铜的混合物17.2克恰好完全,反应后称量为12.8克,求原混合物中碳与氧化铜的质量比.(结果化为整数比)
【答案】解:根据质量守恒定律可知,生成二氧化碳质量为:17.2g﹣12.8g=4.4g,
设原混合物中碳的质量为x,
C+2CuO ![]() 2Cu+CO2↑,
2Cu+CO2↑,
12 44
x 4.4g![]() ,
,
x=1.2g,
则原混合物中氧化铜的质量为:17.2g﹣1.2g=16g,
所以,原混合物中碳和氧化铜的质量比为:1.2g:16g=3:40,
答:原混合物中碳和氧化铜的质量比为3:40
【解析】高温条件下,碳和氧化铜反应生成铜和二氧化碳,根据反应化学方程式和提供的数据可以计算原混合物中碳与氧化铜的质量比.
【考点精析】根据题目的已知条件,利用根据化学反应方程式的计算的相关知识可以得到问题的答案,需要掌握各物质间质量比=系数×相对分子质量之比.

练习册系列答案
相关题目
【题目】小王同学设计了如下的探究物质燃烧条件的三个对比实验: 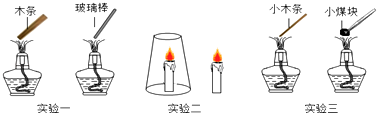
(1)请根据各实验现象,帮助小王同学完成下列实验报告:
步骤 | 设计意图 | 实验现象 | 实验结论 |
实验1 | 燃烧与物质的关系 | 可燃物才能燃烧 | |
实验2 | 玻璃杯内蜡烛熄灭,外面的仍燃烧 | ||
实验3 | 燃烧与温度的关系 | 小木条很快燃烧,小煤块很久才燃烧 |
(2)干粉灭火器中的干粉主要成分是碳酸氢钠,受热时分解为碳酸钠、二氧化碳和水,写出反应的化学方程式;在灭火过程中,水的主要作用是 .