题目内容
已知4.6g 乙醇(化学式为C2H5OH)与8.0g 氧气恰好完全反应,生成4.4g 二氧化碳、5.4g 水和某物质X.有关说法不正确的是( )
| A、乙醇分子中碳、氢、氧三种原子的个数比为2:6:1 |
| B、物质X中一定含有氧元素 |
| C、物质X的质量为2.8g |
| D、物质X的化学式为C2O |
考点:质量守恒定律及其应用
专题:化学用语和质量守恒定律
分析:A、根据物质的化学式可以计算构成原子的个数比;
B、通过计算可以判断X中是否含有氧元素;
C、化学反应遵循质量守恒定律,即参加反应的物质的质量之和,等于反应后生成的物质的质量之和;
D、根据组成物质的元素及其质量,可以判断物质的化学式.
B、通过计算可以判断X中是否含有氧元素;
C、化学反应遵循质量守恒定律,即参加反应的物质的质量之和,等于反应后生成的物质的质量之和;
D、根据组成物质的元素及其质量,可以判断物质的化学式.
解答:解:A、乙醇分子中碳、氢、氧三种原子的个数比为2:6:1,该选项说法正确;
B、4.6g乙醇中碳元素的质量为:4.6g×
×100%=2.4g,氢元素的质量为:4.6g×
×100%=0.6g,氧元素的质量为:4.6g-2.4g-0.6g=1.6g;
4.4g二氧化碳中碳元素的质量为:4.4g×
×100%=1.2g,氧元素的质量为:4.4g-1.2g=3.2g;
5.4g水中氢元素的质量为:5.4g×
×100%=0.6g,氧元素的质量为:5.4g-0.6g=4.8g,
物质X中氧元素的质量为:1.6g+8.0g-3.2g-4.8g=1.6g,即物质X中一定含有氧元素,该选项说法正确;
C、物质X的质量为:4.6g+8.0g-4.4g-5.4g=2.8g,该选项说法正确;
D、物质X中氢元素的质量为:0.6g-0.6g=0,
物质X中碳元素的质量为:2.4g-1.2g=1.2g,
物质X中碳原子和氧原子的个数比为:
:
=1:1,即X的化学式是CO,该选项说法不正确.
故选:D.
B、4.6g乙醇中碳元素的质量为:4.6g×
| 24 |
| 46 |
| 6 |
| 46 |
4.4g二氧化碳中碳元素的质量为:4.4g×
| 12 |
| 44 |
5.4g水中氢元素的质量为:5.4g×
| 2 |
| 18 |
物质X中氧元素的质量为:1.6g+8.0g-3.2g-4.8g=1.6g,即物质X中一定含有氧元素,该选项说法正确;
C、物质X的质量为:4.6g+8.0g-4.4g-5.4g=2.8g,该选项说法正确;
D、物质X中氢元素的质量为:0.6g-0.6g=0,
物质X中碳元素的质量为:2.4g-1.2g=1.2g,
物质X中碳原子和氧原子的个数比为:
| 1.2g |
| 12 |
| 1.6g |
| 16 |
故选:D.
点评:化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、进行相关方面计算的基础.

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
在一个密闭的容器中有XYZQ四种物质,在一定的条件下充分反应,测得反应前后各物质的质量见右表,判断该容器内发生的化学反应的基本类型( )
| 物质 | X | Y | Z | Q |
| 反应前质量/g | 1 | 1 | 42 | 2.5 |
| 反应后质量/g | 待测 | 12 | 0 | 7 |
| A、分解反应 | B、化合反应 |
| C、氧化反应 | D、还原反应 |
实验室中利用氯酸钾KClO3、过氧化氢、水、高锰酸钾等都可以获得氧气,其原因是( )
| A、都属于氧化物 |
| B、都含有氧气 |
| C、都含有氧分子 |
| D、都含有氧元素 |
下列应用及相应原理(用化学方程式表示)、基本反应类型都正确的是( )
A、工业制取氧气:2H2O2
| ||||
B、碳在氧气中充分燃烧:2C+O2
| ||||
C、天然气燃烧 CH4+2O2
| ||||
D、氢气还原氧化铜:H2+CuO
|
下列实验操作正确的是( )
A、 |
B、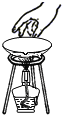 |
C、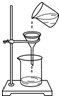 |
D、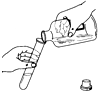 |
已知分子的质量越小,分子运动速度越快,且氯化氢分子的质量大于氨气分子的质量,如图在玻璃管两端的棉花上分别滴上浓氨水和浓盐酸,已知浓氨水易挥发出氨气,浓盐酸易挥发出氯化氢气体.氨气和氯化氢两种气体接触后会产生大量白烟,则白烟较多较浓的点是( )


| A、A点 | B、B点 |
| C、C点 | D、无法确定 |
下列物质的用途不正确的是( )
A、 液氮作冷冻麻醉 |
B、 氮气作闪光灯 |
C、 二氧化碳作肥料 |
D、 氧气用于炼钢 |
 某化学活动小组以“酸碱盐的性质”为主题进行探究性学习,请你作为该小组成员一起来解决下列问题:
某化学活动小组以“酸碱盐的性质”为主题进行探究性学习,请你作为该小组成员一起来解决下列问题: