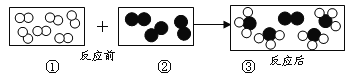
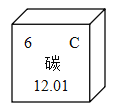
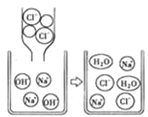
题目内容
【题目】如图是a、b、c三种物质的溶解度曲线,据图回答下列问题:
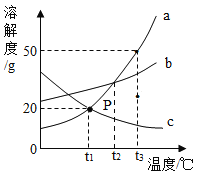
(1)三种物质的溶解度随着温度升高而减小的是____。
(2)t2℃时,物质a的溶解度与物质____的溶解度相等。
(3)t3℃时,把80g物质a加入到200g水中充分搅拌、静置,形成的是_____溶液(填“饱和”或“不饱和”)。
(4)若a中混有少量的b,最好采用____________的方法提纯a。
(5)t3℃时,将等质量a和b的饱和溶液降到t1℃时,析出晶体的质量关系正确的是__(填序号)。
A a>b B a=b C a<b D 不能确定
【答案】物质c b 不饱和 降温结晶(或冷却热饱和溶液) A
【解析】
(1)通过分析溶解度曲线可知,三种物质的溶解度随着温度升高而减小的是c;
(2)t2℃时,物质a的溶解度与物质b的相等;
(3)t3℃时,a物质的溶解度是50g,所以把80g物质a加入到200g水中充分搅拌、静置,形成的是不饱和溶液;
(4)a物质的溶解度受温度影响大,若a中混有少量的b,最好采用降温结晶的方法提纯a;
(4)t3℃时,a物质的溶解度大于b物质的溶解度,将等质量a和b的饱和溶液降到t1℃时,b物质的溶解度大于a物质的溶解度,所以析出晶体的质量关系正确的是a>b,故选:A。
答案为:(1)c;(2)b;(3)不饱和;(4)A。

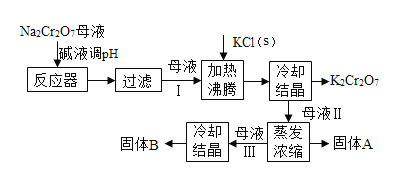
【题目】工业上用重铬酸钠(Na2Cr2O7)结晶后的母液(含少量杂质Fe3+)生产重铬酸钾(K2Cr2O7),其生产流程和相关物质的溶解度曲线及溶解度数据如图(假设流程中反应恰好完全进行):
物质 | 溶解度(g/100g H2O) | ||
0℃ | 40℃ | 80℃ | |
KCl | 28 | 40.1 | 51.3 |
NaCl | 35.7 | 36.4 | 38 |
K2Cr2O7 | 4.7 | 26.3 | 73 |
Na2Cr2O7 | 163 | 215 | 376 |
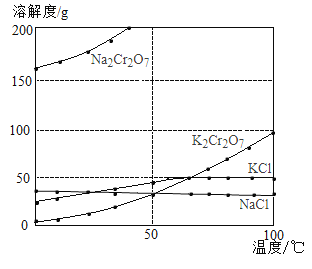
(1)由溶解度曲线可知,50℃时,K2Cr2O7、KCl、NaCl三种物质溶解度的大小关系为_____________,100℃时,用等质量的K2Cr2O7、KCl、NaCl三种固体配制成饱和溶液,溶液质量大小关系为_____________。
(2)将40℃四种物质的饱和溶液降温至0℃,溶质质量分数最小的是______________。
(3)加碱液调节pH的目的是____________。
(4)加入氯化钾固体后,反应的化学方程式为___________。根据溶解度数据可知,该反应能够发生的原因是____________。
(5)流程中要得到母液Ⅲ和固体A的操作为___________,蒸发浓缩原因是___________。
【题目】如图是实验室制取气体的常用装置,请回答有关问题:
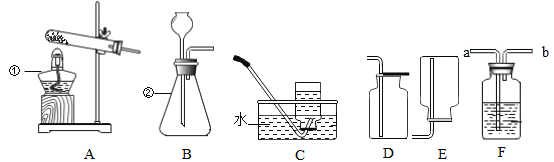
(1)写出图中标号仪器的名称:①_________,②_________。
(2)根据所给装置制取并收集不同的气体,完成下列表格:
气体 | 药品选择 | 反应原理 | 发生装置 | 收集装置 |
O2 | 氯酸钾和二氧化锰 | ________ | A | C或D |
CO2 | 大理石和______ |
| _______ | D |
H2 | 锌与稀硫酸 |
| B | C或_____ |
(3)若用68g未知浓度的过氧化氢溶液与2g二氧化锰制取氧气,完全反应后,称得剩余物质的质量为68.4g,则制得氧气的质量为_____g,该过氧化氢溶液中溶质的质量分数为______。
(4)用D装置收集二氧化碳;检验二氧化碳是否集满的操作是_______。
(5)若用F装置来干燥氢气,则装置中的试剂为________(填名称)。